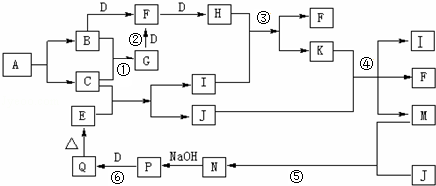
题目内容
3.常温下,下列各组离子在指定溶液中能大量共存的是( )| A. | 甲基橙呈红色的溶液:NH4+、Ba2+、AlO2-、Cl- | |
| B. | 遇苯酚显紫色的溶液:I-、K+、SCN-、Mg2+ | |
| C. | 由水电离出的c(H+)c(OH-)═10-22的溶液:Fe2+、Na+、NO3-、SO42- | |
| D. | 澄清透明的溶液中SO42-、K+、Cu2+、Cl- |
分析 A.甲基橙呈红色的溶液中存在大量氢离子,偏铝酸根离子与铵根离子、氢离子反应;
B.遇苯酚显紫色的溶液中存在铁离子,铁离子能够氧化碘离子,还能够与硫氰根离子反应;
C.由水电离出的c(H+)c(OH-)═10-22的溶液中存在大量氢离子或氢氧根离子,亚铁离子与氢氧根离子反应,硝酸根离子在酸性条件下能够氧化亚铁离子;
D.四种离子之间不反应,能够共存.
解答 解:A.甲基橙呈红色的溶液为酸性溶液,溶液中存在大量氢离子,NH4+、H+与AlO2-发生反应,在溶液中不能大量共存,故A错误;
B.遇苯酚显紫色的溶液中存在Fe3+和,Fe3+与SCN-生成络合物,Fe3+能够氧化I-,在溶液中不能大量共存,故B错误;
C.由水电离出的c(H+)c(OH-)═10-22的溶液为酸性或碱性溶液,Fe2+与氢氧根离子反应,NO3-在酸性条件下能够氧化Fe2+,在溶液中不能电离出,故C错误;
D.SO42-、K+、Cu2+、Cl-之间不发生反应,为澄清透明溶液,能够大量共存,故D正确;
故选D.
点评 本题考查离子共存的判断,题目难度中等,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间;能发生络合反应的离子之间(如 Fe3+和 SCN-)等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”等.

练习册系列答案
相关题目
13.下列物质的类别与所含能团都正确的是( )
①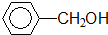 酚类-OH
酚类-OH
②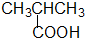 羧酸类-COOH
羧酸类-COOH
③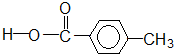 醛类
醛类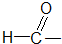
④CH3-O-CH3 醚类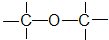
⑤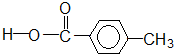 酯类
酯类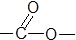
①
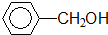 酚类-OH
酚类-OH②
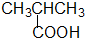 羧酸类-COOH
羧酸类-COOH③
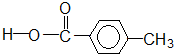 醛类
醛类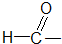
④CH3-O-CH3 醚类
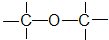
⑤
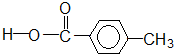 酯类
酯类
| A. | ①②③④⑤ | B. | ②④ | C. | ②③④ | D. | ②④⑤ |
14.铁与铁合金是生活中常见的材料,下列说法正确的是( )
| A. | 铁与盐酸反应,铁合金不与盐酸反应 | |
| B. | 纯铁的硬度和强度均高于铁合金 | |
| C. | 不锈钢是铁合金,只含金属元素 | |
| D. | 一定条件下,铁粉可与水蒸气反应 |
11. 可逆反应:mA(g)+nB(g)?eC(g)+fD(s),反应过程中,当其他条件不变时,C的体积分数[a(C)]在不同温度(T)和不同压强(P)的条件下随时间(t) 的变化关系如图,下列叙述正确的是( )
可逆反应:mA(g)+nB(g)?eC(g)+fD(s),反应过程中,当其他条件不变时,C的体积分数[a(C)]在不同温度(T)和不同压强(P)的条件下随时间(t) 的变化关系如图,下列叙述正确的是( )
 可逆反应:mA(g)+nB(g)?eC(g)+fD(s),反应过程中,当其他条件不变时,C的体积分数[a(C)]在不同温度(T)和不同压强(P)的条件下随时间(t) 的变化关系如图,下列叙述正确的是( )
可逆反应:mA(g)+nB(g)?eC(g)+fD(s),反应过程中,当其他条件不变时,C的体积分数[a(C)]在不同温度(T)和不同压强(P)的条件下随时间(t) 的变化关系如图,下列叙述正确的是( )| A. | 化学方程式中:m+n>e | |
| B. | 达到平衡后,使用催化剂,C的体积分数将增大 | |
| C. | 达到平衡后,若温度升高,化学平衡向逆反应方向移动 | |
| D. | 达到平衡后,若增大体系的压强,化学平衡向正反应方向移动 |
8.下列有关实验操作的说法中,正确的是( )
| A. | 乙烷中混有乙烯,通过盛有酸性KMnO4溶液的洗气瓶洗气除去乙烯 | |
| B. | 检验C2H5Cl中氯原子时,将C2H5Cl和NaOH溶液混合加热后,先加入稀硫酸酸化,再滴加硝酸银溶液 | |
| C. | 用无水乙醇和浓H2SO4共热至140℃可以制得乙烯气体 | |
| D. | 实验室制取乙炔时,常用饱和食盐水代替水 |
15.下列说法正确是( )
| A. | 含有极性键的分子一定是极性分子 | B. | 单质分子一定是非极性分子 | ||
| C. | 氢键一定与氢元素有关 | D. | 共价键只存在于非金属元素之间 |
12.下列性质中不是所有金属共有的是( )
| A. | 不透明 | B. | 易与氧气反应 | C. | 易导热 | D. | 易导电 |
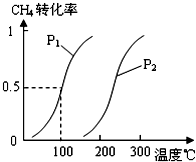 甲醇被称为2l世纪的新型燃料,工业上通过下列反应①②,用CH4和H2O为原料来制备甲醇.
甲醇被称为2l世纪的新型燃料,工业上通过下列反应①②,用CH4和H2O为原料来制备甲醇.