题目内容
14.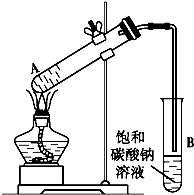 乙酸乙酯是重要的化工原料.实验室合成乙酸乙酯的装置如下图所示.
乙酸乙酯是重要的化工原料.实验室合成乙酸乙酯的装置如下图所示.有关数据及副反应:
| 乙酸 | 乙醇 | 乙酸乙酯 | C2H5OC2H5(乙醚) | |
| 沸点/℃ | 118 | 78.3 | 77.1 | 34.5 |
| 溶解性 | 易溶于水 | 极易溶于水 | 与乙醚混溶 | 微溶于水 |
(2)试管B中导管接近液面未伸入液面下的理由是防止倒吸.
(3)现对试管B中乙酸乙酯粗产品进行提纯,步骤如下:
①将试管B中混合液体充分振荡后,转入分液漏斗(填仪器名称)进行分离;
②向分离出的上层液体中加入无水硫酸钠,充分振荡.加入无水硫酸钠的目的是除去乙酸乙酯中的水.
③将经过上述处理的液体放入干燥的蒸馏烧瓶中,对其进行蒸馏,收集77℃左右的液体即得纯净的乙酸乙酯.
(4)从绿色化学的角度分析,使用浓硫酸制乙酸乙酯不足之处主要有产生酸性废水,污染环境,同时发生副反应.
(5)炒菜时,加一点白酒和醋能使菜肴味香可口,试用符合实际情况的化学方程式解释:CH3COOH+CH3CH2OH$→_{△}^{浓硫酸}$CH3COOCH2CH3+H2O.
分析 (1)为防止酸液飞溅,应先加入乙醇,然后在加入浓硫酸和乙酸;
(2)导管不能插入液面下的原因是防止倒吸;
(3)根据乙酸乙酯不溶于饱和碳酸钠,采用分液的方法分离,再用无水硫酸钠除去乙酸乙酯中的水,最后蒸馏可得纯净的乙酸乙酯;
(4)反应需要浓硫酸作催化剂,产生酸性废水,同时乙醇发生副反应;
(5)白酒中的乙醇和醋中的乙酸发生酯化反应,生成乙酸乙酯和水,使菜肴昧香可口.
解答 解:(1)制取乙酸乙酯时,应先加入乙醇,然后在加入浓硫酸和乙酸,若先加浓硫酸会出现酸液飞溅,
故答案为:乙醇;浓硫酸;乙酸;
(2)导管要插在饱和碳酸钠溶液的液面上,伸入液面下会发生倒吸,
故答案为:防止倒吸;
(3)①将试管B中混合液体充分振荡后,转入分液漏斗进行分离,
故答案为:分液漏斗;
②加入无水硫酸钠的目的是除去粗产品中的水,
故答案为:除去乙酸乙酯中的水;
③77.1℃时乙酸乙酯汽化,因此收集77℃的产品,
故答案为:77;
(4)反应需要浓硫酸作催化剂,产生酸性废水,同时乙醇发生副反应,
故答案为:产生酸性废水,污染环境,同时发生副反应;
(5)白酒中的乙醇和醋中的乙酸发生酯化反应,生成乙酸乙酯和水,反应的化学方程式为:CH3COOH+CH3CH2OH$→_{△}^{浓硫酸}$CH3COOCH2CH3+H2O,
故答案为:CH3COOH+CH3CH2OH$→_{△}^{浓硫酸}$CH3COOCH2CH3+H2O.
点评 本题通过乙酸乙酯的制备,考查了制备方案的设计,注意掌握混合物的分离和提纯方法,明确实验的实验原理是解答该题的关键,试题培养了学生的分析能力及化学实验能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
4.钢铁在潮湿的空气中会被腐蚀,发生的原电池反应为:2Fe+2H2O+O2═2Fe2++4OH-.说法正确的是( )
| A. | 负极发生的反应为:Fe-3e-═Fe3+ | |
| B. | 正极发生的反应为:2H2O+O2+2e-═4OH- | |
| C. | 原电池是将电能转变为化学能的装置 | |
| D. | 钢柱在水下部分比在空气与水交界处更难腐蚀 |
5.向1L0.5mol/L的NaOH溶液中加入下列物质:①稀醋酸 ②浓硫酸 ③稀硝酸,恰好完全反应时的热效应△H1、△H2、△H3的关系正确的是( )
| A. | △H1>△H2>△H3 | B. | △H1<△H3<△H2 | C. | △Hl<△H2<△H3 | D. | △H1>△H3>△H2 |
2.设NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 在常温常压下,11.2 L氧气所含的分子数为0.5NA | |
| B. | 在常温常压下,1molHe的体积为22.4 L | |
| C. | 32 g氧气所含的原子数目为2NA | |
| D. | 在同温同压下,相同体积的任何气体所含的原子数相等 |
9.将一定质量的镁、铜合金加入到稀硝酸溶液中,两者恰好完全反应,假设反应过程中还原产物全是NO,向所得溶液中加入物质的量浓度为3 mol/L NaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1 g,则下列有关叙述正确的是( )
| A. | 开始加入合金的质量可能为3.0 g | |
| B. | 参加反应的硝酸的物质的量是0.1 mol | |
| C. | 完全生成沉淀时消耗NaOH溶液的体积为100 mL | |
| D. | 溶解合金时收集到NO气体的体积为2.24 L |
19.甲烷和氯气的混合气体在光照条件下发生反应,生成氯化氢、一氯甲烷、二氯甲烷、三氯甲烷和四氯甲烷.下列有关说法正确的是( )
| A. | 该反应既是取代反应又是置换反应 | |
| B. | 一氯甲烷的电子式是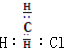 | |
| C. | 二氯甲烷分子有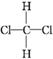 和 和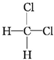 两种空间结构 两种空间结构 | |
| D. | 三氯甲烷和四氯甲烷是工业上重要的溶剂 |
6.下列关于有机物的说法不正确的是( )
| A. | 黄酒中某些微生物使乙醇氧化为乙酸,于是酒就变酸了 | |
| B. | HNO3能与苯、甲苯、甘油、纤维素等有机物发生重要反应,常用浓硫酸作催化剂 | |
| C. | 石油裂解和油脂皂化都有高分子生成小分子的过程 | |
| D. | 乙醇、乙酸、乙酸乙酯都能发生取代反应,乙酸乙酯中的少量乙酸可用饱和Na2CO3溶液除去 |
17.关于反应Al2O3+N2+3C═2AlN+3CO,下列说法错误的是( )
| A. | AlN是氧化产物,其中N是+3价 | B. | 氧化剂是N2,还原剂是C | ||
| C. | Al2O3既不是氧化剂,也不是还原剂 | D. | 每生成2mol AlN,有6mol电子转移 |