题目内容
18.环己酮(如图1)是一种重要的化工原料,实验室常用下列原理和装置制备(部分夹持仪器未画出)(如图2):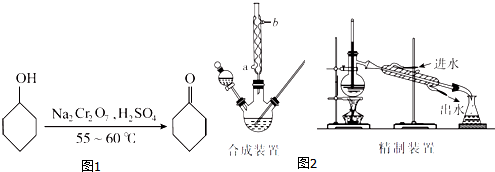
环己醇、环己酮和水的部分物理性质见下表(*括号中的数据表示该有机物与水形成的具有固定组成的混合物的沸点):
| 物质 | 相对分子质量 | 沸点(℃) | 密度(g•cm-3,20℃) | 溶解性 |
| 环己醇 | 100 | 161.1(97.8)* | 0.9624 | 能溶于水 |
| 环己酮 | 98 | 155.6(95)* | 0.9478 | 微溶于水 |
| 水 | 18 | 100.0 | 0.9982 |
A.一次性加入
B.缓慢加入
C.无所谓,怎样加入都可以
(2)若酸性Na2Cr2O7溶液的体积为35 mL,则应选取100mL(填“100 mL”或“250 mL”)的三颈瓶.
(3)反应完成后,加入适量水,蒸馏,收集95~100℃的馏分(设为A),其主要成分是环己酮和水的混合物.
(4)合成装置中冷凝管的作用是冷凝回流,冷凝水从冷凝管的a(填“a”或“b”)口进入.
(5)在馏分A中加入氯化钠固体至饱和,振荡、静置、分液,得有机层(设为B).加入氯化钠固体的作用是降低有机物在水层得溶解度,有利于液体分层.
(6)在有机层B中加入无水硫酸镁固体,除去其中的少量水分.过滤,将滤液置于精制装置中蒸馏,收集B(填代号)的馏分,得到纯净的环己酮.
A.100.0~102.0℃
B.154.0~156.0℃
C.160.0~162.0℃
(7)精制装置中的错误是温度计的水银球未与蒸馏烧瓶支管口平齐(或冷凝水进、出口方向颠倒).(任写一点)
(8)若最终得到环己酮的质量为3.43 g,则环己酮的产率是70%.
分析 (1)酸性Na2Cr2O7溶液应缓慢加入,防止剧烈反应导致温度过高;
(2)液体体积一般不能超过容器容积的$\frac{1}{2}$即可;
(3)95℃时得到环己酮和水的恒沸溶液,100℃的馏分是水;
(4)合成装置中的冷凝管是直立的,未收集生成物,其作用是冷凝回流,采取逆流原理通入冷凝水;
(5)环己酮的密度与水接近,不容易分层,用饱和食盐水可降低有机物在水层得溶解度;
(6)环己酮的沸点是155.6℃,所以宜收集154.0~156.0℃的馏分;
(7)温度计的水银球未与蒸馏烧瓶支管口平齐,冷凝水进、出口方向颠倒;
(8)根据环己醇计算理论上得到环己酮的质量,产率=$\frac{实际产量}{理论产量}$×100%.
解答 解:(1)合成环己酮的反应是放热反应,酸性Na2Cr2O7溶液应缓慢加入,防止剧烈反应导致温度过高,减少副反应发生,
故选:B;
(2)反应液的总体积是40.2mL,液体体积一般不能超过容器容积的$\frac{1}{2}$即可,所以应选择100mL三颈瓶,
故答案为:100mL;
(3)95℃时得到环己酮和水的恒沸溶液,100℃的馏分是水,所以95~100℃的馏分是环己酮和水的混合物,
故答案为:环己酮和水;
(4)合成装置中的冷凝管是直立的,未收集生成物,所以其作用是冷凝回流,提高原料的利用率,采取逆流原理通入冷凝水,充分冷却,即冷凝水从冷凝管的a口进入,
故答案为:冷凝回流;a;
(5)环己酮的密度与水接近,不容易分层,用饱和食盐水可降低有机物在水层得溶解度,有利于分层,
故答案为:降低有机物在水层得溶解度,有利于液体分层;
(6)环己酮的沸点是155.6℃,所以宜收集154.0~156.0℃的馏分,
故答案为:B;
(7)装置中,温度计的水银球未与蒸馏烧瓶支管口平齐,冷凝水进、出口方向颠倒,
故答案为:温度计的水银球未与蒸馏烧瓶支管口平齐(或冷凝水进、出口方向颠倒);
(8)5g环己醇理论上得到环己酮为5g×$\frac{98}{100}$=4.9g,所以产率是$\frac{3.43g}{4.9g}$×100%=70%,
故答案为:70%.
点评 本题考查有机化学实验的反应原理、物质的提纯与除杂等,是对学生综合能力的考查,难度中等.

 名题金卷系列答案
名题金卷系列答案 优加精卷系列答案
优加精卷系列答案| A. | 溶质的电离方程式为NaHCO3=Na++H++CO32- | |
| B. | 25℃时,加水稀释后,n(H+)与n( OH-)的乘积变大 | |
| C. | 离子浓度关系:c( Na+)+c(H+)=c( OH-)+c( HCO3- )+c( CO32-) | |
| D. | 温度升高,c(HCO3-)增大 |
| A. | 开始加入合金的质量可能为3.0 g | |
| B. | 参加反应的硝酸的物质的量是0.1 mol | |
| C. | 完全生成沉淀时消耗NaOH溶液的体积为100 mL | |
| D. | 溶解合金时收集到NO气体的体积为2.24 L |
| A. | 黄酒中某些微生物使乙醇氧化为乙酸,于是酒就变酸了 | |
| B. | HNO3能与苯、甲苯、甘油、纤维素等有机物发生重要反应,常用浓硫酸作催化剂 | |
| C. | 石油裂解和油脂皂化都有高分子生成小分子的过程 | |
| D. | 乙醇、乙酸、乙酸乙酯都能发生取代反应,乙酸乙酯中的少量乙酸可用饱和Na2CO3溶液除去 |
| A. | 原始社会人类学会利用火,他们以天然气取暖,吃熟食,从事生产活动 | |
| B. | 多年来我国广大农村生火做饭使用的都是化石燃料 | |
| C. | 多能源时代指的是新能源时代,包括核能、太阳能、氢能 | |
| D. | 化石燃料的燃烧没有污染 |
| A. | 上述反应中氧化产物只有N2 | |
| B. | 经测定,NaCN的水溶液呈碱性,说明CN-能促进水的电离 | |
| C. | 若上述反应生成0.4molCO2,则溶液中阴离子增加的物质的量为2mol | |
| D. | 现取1L含CN-1.04mg/L的废水,理论需用4.010-5molCl2处理 |
 .
.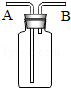 下面关于图所示实验装置的使用方法中叙述正确的是( )
下面关于图所示实验装置的使用方法中叙述正确的是( )