题目内容
9.硅及其化合物在工业上有广泛用途,以硅粉、镁粉等原料制备硅烷的工业流程如下: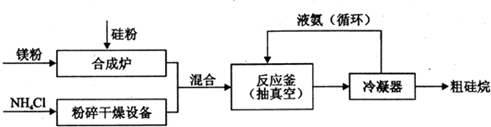
反应釜中发生反应:4NH4Cl+Mg2Si$\stackrel{常温}{?}$4NH3↑+SiH4↑+2MgCl2△H<0
(1)工业上可用硅烷和氨气生产一种能耐高温的材料Si3 N4,Si3 N4应属于原子晶体;NH3、Si3 N4和SiH4三种物质的熔沸点由高到低的顺序是Si3N4>NH3>SiH4.
(2)上述生产硅烷的过程中反应釜抽真空的原因是使4NH4Cl+Mg2Si$\stackrel{常温}{?}$4NH3↑+SiH4↑+2MgCl2平衡正移,有利于生产硅烷.
(3)液氨参与循环的作用是吸收热量,保证反应在常温下进行.
(4)氨气也是重要的工业原料,1mol氨气在一定温度下(T>150℃)发生催化氧化反应能释放出226.5kJ的热量,该反应的热化学方程式是4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H=-906.0 kJ/mol.
(5)三硅酸镁(Mg2Si3O8•nH2O)难溶于水,在医药上可做抗酸剂.它可以中和多余胃酸(主要成分盐酸),生成的难溶物还可覆盖在有溃疡的胃表面,保护其不再受刺激.三硅酸镁与胃酸反应的化学方程式是MgSi3O8•nH2O+4HCl═2MgCl2+3SiO2+(n+2)H2O.若将1.84g三硅酸镁加到50mL 1.0mol/L盐酸中,充分反应后,滤去沉淀,以甲基橙为指示剂,用l.0mol/L NaOH溶液滴定剩余的盐酸,消耗NaOH溶液30mL,则Mg2Si3O8•nH2O中n的值是6.
分析 (1)相邻原子之间通过强烈的共价键结合而成的空间网状结构的晶体叫做原子晶体,其构成微粒是原子;不同类型晶体熔沸点高低的比较:一般来说,原子晶体>离子晶体>分子晶体;分子晶体中含有氢键的熔沸点较高;同种类型的分子晶体相对分子质量越大,熔沸点越高;
(2)生产硅烷的反应为可逆反应,抽成真空,能使反应平衡正移,有利于生产硅烷;
(3)根据氨的性质分析:氨气易液化,液氨气化时能从周围环境吸热降温;
(4)依据热化学方程式的书写方法分析书写,反应热与化学计量数成正比;
(5)根据书写化学方程式的步骤:写配注等,正确书写方程式即可,三硅酸镁和盐酸反应生成氯化镁、二氧化硅和水,根据化学方程式进行计算Mg2Si3O8•nH2O中n的值.
解答 解:(1)相邻原子之间通过强烈的共价键结合而成的空间网状结构的晶体叫做原子晶体,其构成微粒是原子;原子晶体具有熔点高和硬度大的特点,氮化硅(Si3N4)是一种耐高温材料,说明氮化硅属于原子晶体,NH3、Si3N4和SiH4三种物质,Si3N4为原子晶体,NH3、SiH4是分子晶体,则熔沸点顺序为:Si3N4>NH3、SiH4,NH3中含有氢键、SiH4中不含氢键,所以NH3的熔沸点较高,即Si3N4>NH3>SiH4,
故答案为:原子;Si3N4>NH3>SiH4;
(2)生产硅烷的反应为4NH4Cl+Mg2Si$\stackrel{常温}{?}$4NH3↑+SiH4↑+2MgCl2,该反应为可逆反应,正反应为气体体积增大的反应,抽成真空,有利于反应平衡正向移动,有利于生产硅烷,
故答案为:使4NH4Cl+Mg2Si$\stackrel{常温}{?}$4NH3↑+SiH4↑+2MgCl2平衡正移,有利于生产硅烷;
(3)氨气易液化,液氨气化时能从周围环境吸热降温,上述生产硅烷的过程中液氨的作用是:吸收热量,保证反应在常温下进行,
故答案为:吸收热量,保证反应在常温下进行(答“制冷”或“降温”均可);
(4)氨气催化氧化反应生成一氧化氮和水,反应的化学方程式为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,1mol氨气在一定温度下(T>150℃)发生催化氧化反应能释放出226.5kJ的热量,则4mol氨气在一定温度下(T>150℃)发生催化氧化反应能释放出226.5kJ×4=906KJ的热量,所以该反应的热化学方程式是:4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H=-906.0 kJ/mol,
故答案为:4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H=-906.0 kJ/mol;
(5)三硅酸镁中和胃酸(HCl)的化学方程式为:MgSi3O8•nH2O+4HCl═2MgCl2+3SiO2+(n+2)H2O,根据化学方程式,设0.184gMgSi3O8•nH2O的物质的量是x,得
MgSi3O8•nH2O+4HCl═2MgCl2+3SiO2+(n+2)H2O
1 4
x 0.050L×1mol/L-0.030L×1mol/L
$\frac{1}{x}$=$\frac{4}{0.050L×1mol/L-0.030L×1mol/L}$,
解得x=0.005mol,所以MgSi3O8•nH2O的摩尔质量是M=$\frac{m}{n}$=$\frac{1.84}{0.005}$=368g/mol,Mg2Si3O8的摩尔质量为260g/mol,所以18n=108,即n=6.
故答案为:MgSi3O8•nH2O+4HCl═2MgCl2+3SiO2+(n+2)H2O;6.
点评 本题考查较为综合,为高考常见题型,涉及硅、氮及其化合物的性质以及工业流程的理解、复杂化学式的确立等知识,要求学生具有较强的分析和解决问题的能力,明确反应原理是解答本题的关键,题目难度中等.

 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案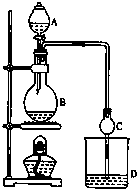 某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.已知:
①无水氯化钙可与乙醇形成难溶于水的CaCl2•6C2H5OH
②有关有机物的沸点:
| 试剂 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点/℃ | 78.5 | 118 | 77.1 |
(1)浓硫酸的作用:催化剂、吸水剂,请用同位素18O示踪法确定该反应原理,写出能表示18O在反应前后位置变化的化学方程式:CH3COOH+CH3CH218OH
 CH3CO18OC2H5+H2O.
CH3CO18OC2H5+H2O.(2)球形干燥管C的作用是防止倒吸、冷凝.
(3)从D中分离出的乙酸乙酯中常含有一定量的乙醇、和水,应先加入无水氯化钙,分离出乙醇,再加入(此空从下列选项中选择)C,然后进行蒸馏,收集77℃左右的馏分,以得到较纯净的乙酸乙酯.
A.五氧化二磷 B.碱石灰 C.无水硫酸钠 D.生石灰.
| 物质 | 熔点(℃) | 沸点(℃) | 密度(g•cm-3) |
| 乙醇 | -117.3 | 78.5 | 0.79 |
| 乙酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.90 |
| 浓硫酸 | - | 338.0 | 1.84 |
①在30mL的大试管A中按体积比2:3:3配制浓硫酸、乙醇和乙酸的混合溶液.
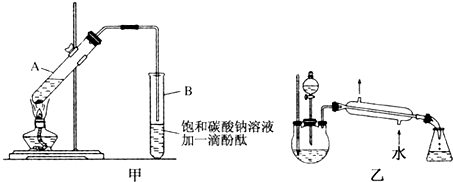
②按图甲连接好装置(装置气密性良好),用小火均匀加热装有混合液的大试管5~10min.
③待试管B收集到一定量产物后停止加热,撤出试管B并用力振荡,然后静置待分层.
④分离出乙酸乙酯层,洗涤、干燥.
请根据题目要求回答下列问题:
(1)配制该混合液的主要操作步骤为在一个30mL的大试管中注入3mL乙醇,再分别缓缓加入2mL浓硫酸、3mL乙酸(乙醇和浓硫酸的加入顺序不可互换),边加边振荡试管使之混合均匀;
(2)步骤②中需要小火均匀加热,其主要原因是反应物乙醇、乙酸的沸点较低,若用大火加热,反应物随产物蒸出而大量损失,而且温度过高可能发生更多的副反应;
(3)指出步骤③所观察到的现象:试管B中的液体分成上下两层,上层无色,下层为红色液体,振荡后下层液体的红色变浅.
分离出乙酸乙酯层后,一般用饱和食盐水或饱和氯化钙溶液洗涤,可通过洗涤主要除去碳酸钠和乙醇(填名称)杂质;为了干燥乙酸乙酯可选用的干燥剂为B(填选项字母).
A.P2O5 B.无水Na2SO4
C.碱石灰 D.NaOH固体
(4)某化学课外小组设计了如图乙所示的制取乙酸乙酯的装置(图中的部分装置略去),与图甲装置相比,图乙装置的主要优点有①增加了温度计,便于控制发生装置中反应液的温度,减少副产物的发生;②增加了分液漏斗,有利于及时补充反应混合液,以提高乙酸乙酯的产量;③增加了冷凝装置,有利于收集产物乙酸乙酯.
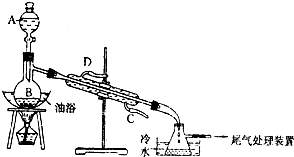 某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中盛有浓硫酸,B中盛有无水乙醇和冰醋酸.
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中盛有浓硫酸,B中盛有无水乙醇和冰醋酸.已知①无水氯化钙可与乙醇形成难溶于水的CaCl2•6C2H5OH.
②有关有机物的沸点如表所示:
| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点(℃) | 34.7 | 78.5 | 118 | 77.1 |
 CH3CO18OCH2CH3+H2O.
CH3CO18OCH2CH3+H2O.(2)用过量乙醇的主要目的是增加一种反应物,有利于酯化反应正向进行.
(3)冷凝管的主要作用是将产物冷凝,则水应从冷凝管的C(填“C”或“D”)端进入.
(4)锥形瓶中收集到的液体的主要成分是乙酸乙酯,为了得到比较纯净的该物质,常用饱和Na2CO3溶液对粗产品进行洗涤,其目的是除去乙酸乙酯中的乙酸和乙醇.如果用NaOH浓溶液代替Na2CO3溶液将引起的后果是导致乙酸乙酯水解.
(5)锥形瓶中液体经饱和碳酸钠溶液洗涤后,加入无水氯化钙,除去乙醇;再加入(此空从下列选项中选择)C,然后进行蒸馏,收集77℃左右的馏分即可.
A.五氧化二磷B.碱石灰C.无水硫酸钠D.生石灰.
 定条件下,对于A2(g)+3B2(g)
定条件下,对于A2(g)+3B2(g) 2AB3(g)反应来说,下列所表示的化学反应速率中最大的
2AB3(g)反应来说,下列所表示的化学反应速率中最大的 是
是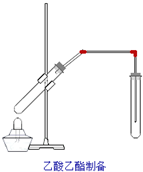 如图,在左试管中先加入2mL 95%的乙醇,并在摇动下缓缓加入3mL浓硫酸,再加入2mL乙酸,充分摇匀.在右试管中加入5mL饱和Na2CO3溶液.按图连接好装置,用酒精灯对左试管小火加热3~5min后,改用大火加热,当观察到右试管中有明显现象时停止实验
如图,在左试管中先加入2mL 95%的乙醇,并在摇动下缓缓加入3mL浓硫酸,再加入2mL乙酸,充分摇匀.在右试管中加入5mL饱和Na2CO3溶液.按图连接好装置,用酒精灯对左试管小火加热3~5min后,改用大火加热,当观察到右试管中有明显现象时停止实验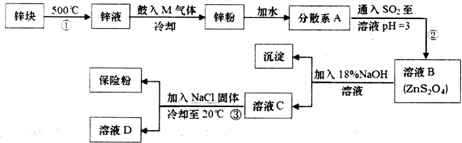
 .分散系A为悬浊液(填“溶液”“胶体”或“悬浊液”).
.分散系A为悬浊液(填“溶液”“胶体”或“悬浊液”).
