题目内容
金属铝与盐酸反应,下列叙述不正确的是( )
| A、铝作还原剂,氢气做氧化产物 |
| B、该反应属于典型的放热反应 |
| C、如果把该反应设计成原电池,铁、锌均可以做正极 |
| D、标况下,转移2mol 电子,就生成22.4L的氢气 |
考点:铝的化学性质
专题:
分析:A、金属铝与盐酸反应,方程式为:2Al+3H+═2Al3++3H2↑,铝为还原剂,盐酸为氧化剂,则氢气是还原产物;
B、金属铝与盐酸反应,方程式为:2Al+3H+═2Al3++3H2↑属于放热反应;
C、把该反应设计成原电池,铝作负极,则比铝不活泼的都可作正极;
D、金属铝与盐酸反应,方程式为:2Al+3H+═2Al3++3H2↑,转移2mol电子,就生成1mol的氢气;
B、金属铝与盐酸反应,方程式为:2Al+3H+═2Al3++3H2↑属于放热反应;
C、把该反应设计成原电池,铝作负极,则比铝不活泼的都可作正极;
D、金属铝与盐酸反应,方程式为:2Al+3H+═2Al3++3H2↑,转移2mol电子,就生成1mol的氢气;
解答:
解:A、金属铝与盐酸反应,方程式为:2Al+3H+═2Al3++3H2↑,铝为还原剂,盐酸为氧化剂,则氢气是还原产物,故A错误;
B、金属铝与盐酸反应,方程式为:2Al+3H+═2Al3++3H2↑属于放热反应,故B正确;
C、把该反应设计成原电池,铝作负极,则比铝不活泼的都可作正极,所以铁、锌均可以做正极,故C正确;
D、金属铝与盐酸反应,方程式为:2Al+3H+═2Al3++3H2↑,转移2mol电子,就生成1mol的氢气,即标况下22.4L,故D正确;
故选:A;
B、金属铝与盐酸反应,方程式为:2Al+3H+═2Al3++3H2↑属于放热反应,故B正确;
C、把该反应设计成原电池,铝作负极,则比铝不活泼的都可作正极,所以铁、锌均可以做正极,故C正确;
D、金属铝与盐酸反应,方程式为:2Al+3H+═2Al3++3H2↑,转移2mol电子,就生成1mol的氢气,即标况下22.4L,故D正确;
故选:A;
点评:本题考查了铝的性质,难度不大,注意基础知识的积累.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列各项比较中前者高于(或大于或强于)后者的是( )
| A、金属Mg和金属Cu的空间利用率 |
| B、C-O和Si-O的键能 |
| C、H2SO3和H2SO4中心原子的价层电子对数 |
D、邻羟基苯甲醛(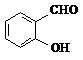 )和对羟基苯甲醛( )和对羟基苯甲醛(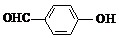 )的沸点 )的沸点 |
下列对某些离子的检验及结论一定正确的是( )
| A、加入Ba(NO3)2溶液,生成白色沉淀,加稀盐酸沉淀不消失,则原溶液中一定有SO42- |
| B、加入碳酸钠溶液有白色沉淀生成,再加盐酸,沉淀消失,则原溶液中一定有Ba2+ |
| C、通入Cl2后,溶液变为黄色,加入淀粉后溶液变蓝,则原溶液中一定有I- |
| D、加入NaOH溶液并加热,产生使湿润蓝色石蕊试纸变红的气体,则原溶液一定有NH4+ |
下列说法正确的是( )
| A、从海水中获取物质必须经过化学变化 |
| B、工业上以氯气和澄清石灰水为原料制取漂白粉 |
| C、海水中蕴含的元素有80多种,其中Mg、Br、I在海水中的总储量分别约为1.8×1015t、1×1014t、8×1010t.由于海水中镁的储量很大,工业上常以海水为原料提取镁,因此,镁元素被称为“海洋元素” |
| D、氯气泄漏现场应采取喷水雾、喷碱性液体,并杜绝火源、电源等措施 |
下列说法不正确的是( )
| A、电解池是将电能转化成化学能的装置 |
| B、化学键断裂时吸收能量,形成时放出能量 |
| C、增大反应物的浓度,可增加单位体积内活化分子数,从而使反应速率增大 |
| D、含0.1molH2SO4的浓硫酸与含0.2molNaOH的溶液混合;放出的热量即为中和热 |