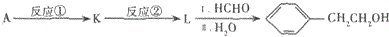题目内容
20.黄铁矿(主要成分为CuFeS2,S为-2价)是工业联通的主要原料,现有一种天然黄铁矿(含SiO2)为了测定该黄铁矿的纯度,设计了如下实验: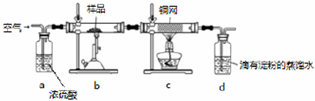
现称取研细的黄铁矿样品1.84g,在空气存在下进行煅烧,发生如下反应:3CuFeS2+8O2$\frac{\underline{\;高温\;}}{\;}$3Cu+Fe3O4+6SO2
试验后d中溶液的$\frac{1}{10}$置于锥形瓶中,用0.0500mol/L标准碘溶液进行滴定,消耗标准溶液20.00mL,请回答下列问题:
(1)3CuFeS2+8O2$\frac{\underline{\;高温\;}}{\;}$3Cu+Fe3O4+6SO2中氧化产物是Fe3O4、SO2 ,当生成0.3molSO2气体时,转移电子1.9mol
(2)将样品研细后再反应,其目的是增大接触面积,使原料充分反应、加快反应速率,装置C的作用是除去多余的氧气
(3)用标准碘溶液滴定d中溶液的离子方程式是SO2+Br2+2H2O=4H++2Br-+SO42-,滴定达中点时的现象是锥形瓶中的溶液由无色变为蓝色且半分钟不褪色
(4)上述反应结束后,仍需通一段时间的空气,其目的是使反应生成的SO2全部进入d装置中,使结果精确
(5)通过计算可知,该黄铜矿的纯度为50%
(6)若将原装置d中的试液换为Ba(OH)2溶液,测得黄铜矿纯度偏高,假设实验操作均正确,可能的原因主要是空气中的CO2与Ba(OH)2反应生成BaCO3沉淀,BaSO3被氧化成BaSO4.
分析 该实验原理是:根据黄铜矿受热分解产生的二氧化硫的量的测定(二氧化硫可以用碘水来标定),结合元素守恒可以确定黄铜矿的量,进而计算其纯度.
(1)CuFeS2,S为-2价元素Cu元素化合价+2价,Fe元素化合价为+2价,反应后铜元素化合价降低,铁元素化合价升高,硫元素化合价升高,氧元素化合价降低,氧化产物是元素化合价升高的被氧化得到氧化产物,依据电子守恒计算电子转移总数;
(2)根据样品称量的精确度来分析;增大固体的表面积可以加快化学反应速浓硫酸可以将水除去,灼热的铜网可以除去多余的氧气;
(3)用标准碘溶液滴定d中溶液的反应是二氧化硫被溴单质氧化生成硫酸和氢溴酸,根据反应结束时的颜色变化判断滴定终点,当达到滴定终点时,二氧化硫已经被碘单质消耗完毕,再滴入一滴碘单质,遇到淀粉会变蓝;
(4)二氧化硫全部被吸收是实验成败的关键;
(5)根据滴定管的读数方法和要求来回答判断,根据反应实质,得到:2I2~2SO2~CuFeS2,结合定量关系计算;
(6)二氧化碳和二氧化硫均可以和氢氧化钡反应生成白色沉淀,亚硫酸钡易被氧化为硫酸钡.
解答 解:该实验原理是:根据黄铜矿受热分解产生的二氧化硫的量的测定(二氧化硫可以用碘水来标定),结合元素守恒可以确定黄铜矿的量,进而计算其纯度.
(1)CuFeS2,S为-2价元素Cu元素化合价+2价,Fe元素化合价为+2价,反应后铜元素化合价降低,铁元素化合价升高,硫元素化合价升高,氧元素化合价降低,氧化产物是元素化合价升高的被氧化得到氧化产物,氧化产物为:Fe3O4、SO2 ,依据电子守恒计算电子转移总数,反应中3Cu2+~3Cu~6e-,8O2~Fe3O4+6SO2
~32e-,生成6molSO2,电子转移总数为38mol,当生成0.3molSO2气体时1.9mol电子,
故答案为:Fe3O4、SO2 ;1.9;
(2)将样品研细后再反应,即增大固体的表面积,目的是使原料充分反应、加快反应速率,灼热的铜网可以除去多余的氧气,
故答案为:增大接触面积,使原料充分反应、加快反应速率;除去多余的氧气;
(3)用标准碘溶液滴定d中溶液的反应是二氧化硫被溴单质氧化生成硫酸和氢溴酸,反应的离子方程式为:SO2+Br2+2H2O=4H++2Br-+SO42-,当达到滴定终点时,二氧化硫已经被碘单质消耗完毕,再滴入一滴碘单质,遇到淀粉会变蓝且半分钟不褪色,证明反应达到反应终点,
故答案为:SO2+Br2+2H2O=4H++2Br-+SO42-,锥形瓶中的溶液由无色变为蓝色且半分钟不褪色;
(4)黄铜矿受热分解生成二氧化硫等一系列产物,分解完毕后仍然通入空气,可以将产生的二氧化硫全部排出去,使结果精确,
故答案为:使反应生成的SO2全部进入d装置中,使结果精确;
(5)根据滴定管的示数是上方小,下方大,可以读出滴定管示数是20.00mL,当达到滴定终点时,二氧化硫已经被碘单质消耗完毕,再滴入一滴碘单质,遇到淀粉会变蓝,根据反应实质,得到:2I2~2SO2~CuFeS2,消耗掉0.05mol/L标准碘溶液20.00mL时,即消耗的碘单质的量为:0.05mol/L×0.02L=0.0010mol,所以黄铜矿的质量是:0.5×0.0010mol×184g/mol×10=0.92g,所以其纯度是:$\frac{0.92g}{1.84g}$×100%=50%,
故答案为:50%;
(6)空气中的CO2与Ba(OH)2反应可以生成BaCO3沉淀,此外BaSO3被氧化成BaSO4均可以导致所以的沉淀的量比二氧化硫和氢氧化钡反应生成的白色沉淀的量多,
故答案为:空气中的CO2与Ba(OH)2反应生成BaCO3沉淀,BaSO3被氧化成BaSO4.
点评 本题考查了探究黄铜矿的纯度,涉及了仪器选择、纯度计算等知识,题量较大,充分考查了学生分析和解决问题的能力,本题难度中等.

 一线名师提优试卷系列答案
一线名师提优试卷系列答案| A. | 它与金刚石互为同素异形体 | |
| B. | 它与C60互称同分异构体 | |
| C. | 它与C60的物理性质与化学性质完全相同 | |
| D. | 它与13C互为同位素 |
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 四 | ⑩ | ⑪ | ⑫ |
(2)在①-⑫元素中,最活泼的金属元素是K(填元素符号,下同),最活泼的非金属元素是F.
(3)在这些元素的最高价氧化和对应水化物中,酸性最强的是HClO4,呈两性的氢氧化物是Al(OH)3,二者之间相互反应的化学方程式为:3HClO4+Al(OH)3=Al(ClO4)3+3H2O.
(4)在这些元素中,原子半径最小的是F.
(5)在③与④中,化学性质较活泼的是Na,怎样用化学实验证明?钠跟水剧烈反应,放出氢气,并生成强碱NaOH;Mg跟水缓慢反应,放出氢气,并生成中强碱Mg(OH)2.
| A. | 原子半径:丙>乙>甲>丁 | |
| B. | 气态氢化物的熔点:丙>甲 | |
| C. | 乙元素在自然界中形成的化合物种类最多 | |
| D. | 乙和甲、丙、丁都一定能形成两种或两种以上的共价化合物 |

已知a、b、c均大于零.下列说法正确的是( )
| A. | H2、I2和HI分子中的化学键都是非极性共价键 | |
| B. | 断开2mol HI分子中的化学键所需能量约为(c+b+a)kJ | |
| C. | 相同条件下,1mol H2(g)和1mol I2(g)总能量小于2molHI(g)的总能量 | |
| D. | 向密闭容器中加入2mol H2(g)和2mol I2(g),充分反应后放出的热量小于2a kJ |
| A. | 通入N2 | B. | 加压 | ||
| C. | 升高温度 | D. | 使用合适的催化剂 |
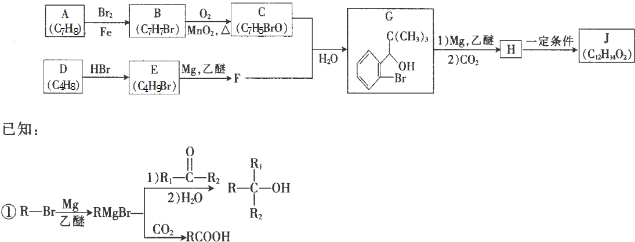
 .
.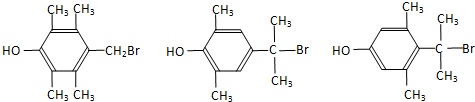 (写出一种即可).
(写出一种即可).