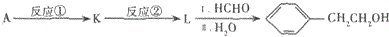题目内容
19.A、B、C、D、E均为短周期元素,其原子序数依次增大.B、D同主族.A的单质是最理想的燃料,B的原子最外层电子数是次外层电子数的3倍,C的焰色反应为黄色.E-与Ar具有相同的核外电子排布.(1)A、B的元素符号分别是H、O.
(2)A、E组成的化合物的电子式是
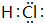 ,其中所含化学键的类型是共价键.
,其中所含化学键的类型是共价键.(3)C、D两种元素的最高价氧化物的水化物的化学式分别是NaOH、H2SO4.
(4)C、D、E按原子半径由大到小的顺序排列为Na>S>Cl(填元素符号).
(5)将E的单质通入NaBr溶液中,发生反应的化学方程式是Cl2+2NaBr=Br2+2NaCl,观察到的现象是溶液由无色变为橙黄色.
分析 A、B、C、D、E均为短周期元素,其原子序数依次增大.A的单质是最理想的燃料,则A为H元素;B的原子最外层电子数是次外层电子数的3倍,原子只能有2个电子层,最外层电子数为6,故B为O元素;B、D同主族,则D为S元素;C的焰色反应为黄色,则C为Na;E-与Ar具有相同的核外电子排布,则E为Cl.
解答 解:A、B、C、D、E均为短周期元素,其原子序数依次增大.A的单质是最理想的燃料,则A为H元素;B的原子最外层电子数是次外层电子数的3倍,原子只能有2个电子层,最外层电子数为6,故B为O元素;B、D同主族,则D为S元素;C的焰色反应为黄色,则C为Na;E-与Ar具有相同的核外电子排布,则E为Cl.
(1)A、B的元素符号分别是H、O,故答案为:H;O;
(2)A、E组成的化合物为HCl,电子式是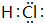 ,其中所含化学键的类型是共价键,故答案为:
,其中所含化学键的类型是共价键,故答案为: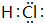 ;共价键;
;共价键;
(3)C、D两种元素的最高价氧化物的水化物的化学式分别是NaOH、H2SO4,故答案为:NaOH;H2SO4;
(4)同周期自左而右原子半径减小,故原子半径Na>S>Cl,故答案为:Na>S>Cl;
(5)将E的单质通入NaBr溶液中,发生反应的化学方程式是:Cl2+2NaBr=Br2+2NaCl,观察到的现象是:溶液由无色变为橙黄色,故答案为:Cl2+2NaBr=Br2+2NaCl;溶液由无色变为橙黄色.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,熟练掌握元素周期表与元素周期律,旨在考查学生对基础知识的巩固.

练习册系列答案
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案
相关题目
7.对于反应3C=A+2B,以下化学反应速率中最快的是( )
| A. | v(B)=0.8mol/(L•s) | B. | v(A)=0.6mol/(L•s) | C. | v(C)=0.9mol/(L•s) | D. | v(B)=1.0mol/(L•s) |
14.X、Y、Z、W均为短周期元素,X+、Y2+、Z-、W2-具有相同的核外电子排布,下列比较中正确的是( )
| A. | 稳定性H2W<HZ | B. | 原子半径Y<Z | C. | 单质的还原性X<Y | D. | 最外层电子数Z<W |
4.某有机物的结构简式如图所示,下列关于该有机物的性质说法错误的是( )


| A. | 该物质可以使酸性KMnO4溶液褪色,也可发生消去反应 | |
| B. | 可以与NaHCO3溶液反应放出CO2气体 | |
| C. | 可以与FeCl3溶液反应显色,也可与Ag(NH3)2OH反应 | |
| D. | 该物质可与H2反应,1mol该物质最多消耗5mol H2反应 |
11.科学家发现C60后,近年又合成了许多球形富勒烯分子,如C70等,下列对C70说法正确的是( )
| A. | 它与金刚石互为同素异形体 | |
| B. | 它与C60互称同分异构体 | |
| C. | 它与C60的物理性质与化学性质完全相同 | |
| D. | 它与13C互为同位素 |
8.如表是元素周期表的一部分,回答下列有关问题:
(1)写出下列元素符号:①N,⑥Si,⑦S.
(2)在①-⑫元素中,最活泼的金属元素是K(填元素符号,下同),最活泼的非金属元素是F.
(3)在这些元素的最高价氧化和对应水化物中,酸性最强的是HClO4,呈两性的氢氧化物是Al(OH)3,二者之间相互反应的化学方程式为:3HClO4+Al(OH)3=Al(ClO4)3+3H2O.
(4)在这些元素中,原子半径最小的是F.
(5)在③与④中,化学性质较活泼的是Na,怎样用化学实验证明?钠跟水剧烈反应,放出氢气,并生成强碱NaOH;Mg跟水缓慢反应,放出氢气,并生成中强碱Mg(OH)2.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 四 | ⑩ | ⑪ | ⑫ |
(2)在①-⑫元素中,最活泼的金属元素是K(填元素符号,下同),最活泼的非金属元素是F.
(3)在这些元素的最高价氧化和对应水化物中,酸性最强的是HClO4,呈两性的氢氧化物是Al(OH)3,二者之间相互反应的化学方程式为:3HClO4+Al(OH)3=Al(ClO4)3+3H2O.
(4)在这些元素中,原子半径最小的是F.
(5)在③与④中,化学性质较活泼的是Na,怎样用化学实验证明?钠跟水剧烈反应,放出氢气,并生成强碱NaOH;Mg跟水缓慢反应,放出氢气,并生成中强碱Mg(OH)2.
9.在平衡体系N2+O2?2NO-Q中,能使氮的转化率提高的措施是( )
| A. | 通入N2 | B. | 加压 | ||
| C. | 升高温度 | D. | 使用合适的催化剂 |
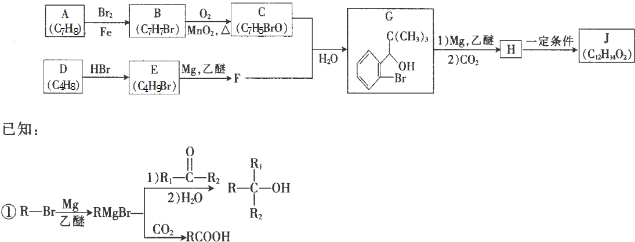
 .
.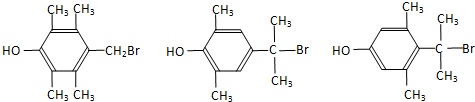 (写出一种即可).
(写出一种即可).