题目内容
8.10ml浓度为1mol/L的盐酸与过量的锌粉反应,若加入适量的下列溶液,能减慢反应速率但又不影响氢气生成的是( )| A. | KOH | B. | CH3COONa | C. | CuSO4 | D. | Na2CO3 |
分析 为了减缓反应进行的速率,加入溶液后应降低氢离子浓度,但又不影响生成氢气的总量,则提供的氢离子的总物质的量不变,而C选项中构成原电池,加快反应速率,A、D选项中消耗氢离子,生成氢气的总量减少,据此进行解答.
解答 解:A.加入KOH溶液,发生中和反应,溶液中氢离子总物质的量减小,影响了氢气的生成量,故A错误;
B,加入CH3COONa溶液,溶液被稀释,且醋酸根与溶液中氢离子结合为醋酸分子,溶液中氢离子浓度降低,且提供的氢离子总量不变,故能减慢反应速率且又不影响氢气生成量,故B正确;
C.Zn可以置换出Cu,构成原电池,加快反应速率,故C错误;
D.加入碳酸钠溶液,与盐酸反应是二氧化碳,氢离子总量较小,生成氢气的量减少,故D错误;
故选B.
点评 本题考查化学反应速率影响因素,题目难度不大,需注意生成氢气的量不变,注意C选项构成原电池,加快反应速率,明确化学反应速率及其影响因素为解答关键,试题培养了学生的灵活应用能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
19.用适量水稀释0.1mol/L氨水时,溶液中随着水量的增加而减小的是( )
| A. | c(OH-) | B. | n(NH4+) | C. | $\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$ | D. | n(OH-) |
16.下列对应关系或事实的解释正确的是( )
| A. | NH4Cl水解呈酸性,不能用来当做肥料使用 | |
| B. | 氧化镁的熔点高,可用于制作耐高温的材料 | |
| C. | 氯碱工业中的“碱”指的是Na2CO3 | |
| D. | 水泥、玻璃等硅酸盐材料指的是以二氧化硅为原料生产的材料 |
20.图中每条折线表示周期表ⅣA~ⅦA中的某一族元素氢化物的沸点变化,每个小黑点代表一种氢化物,其中a点代表的是( )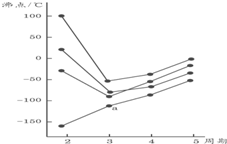

| A. | H2S | B. | CH4 | C. | PH3 | D. | SiH4 |
17.在一定温度下,向2L密闭容器中加入1mol X和2mol Y,发生如下反应:X(g)+2Y(g)?2Z(g),此反应达到平衡的标志是( )
| A. | 容器内气体混合物的密度不随时间变化 | |
| B. | 容器内X、Y、Z浓度之比为1:2:2 | |
| C. | 容器内气体混合物的压强不随时间变化 | |
| D. | 单位时间内消耗0.1mol X,同时生成0.2mol Z |
 ;
; .
.