题目内容
17.在一定温度下,向2L密闭容器中加入1mol X和2mol Y,发生如下反应:X(g)+2Y(g)?2Z(g),此反应达到平衡的标志是( )| A. | 容器内气体混合物的密度不随时间变化 | |
| B. | 容器内X、Y、Z浓度之比为1:2:2 | |
| C. | 容器内气体混合物的压强不随时间变化 | |
| D. | 单位时间内消耗0.1mol X,同时生成0.2mol Z |
分析 可逆反应X(g)+2Y(g)?2Z(g)达到平衡状态时,正逆反应速率相等,各组分的浓度、百分含量不再变化,据此进行判断.
解答 解:A.反应前后气体总质量始终不变,容器容积不变,则密度始终不变,不能根据密度变化判断平衡状态,故A错误;
B.容器内X、Y、Z浓度之比为1:2:2,无法判断正逆反应速率是否相等,则无法判断是否达到平衡状态,故B错误;
C.该反应是气体体积缩小的反应,反应过程中容器内压强不断减小,当压强不变时,表明各组分的浓度不再变化,已经达到平衡状态,故C正确;
D.单位时间内消耗0.1mol X,同时生成0.2mol Z,表示的都是正反应速率,无法判断正逆反应速率是否相等,故D错误;
故选C.
点评 本题考查了化学反应速率及其影响,题目难度不大,明确化学平衡状态的特征为解答关键,注意掌握化学平衡及其影响因素,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案
相关题目
8.10ml浓度为1mol/L的盐酸与过量的锌粉反应,若加入适量的下列溶液,能减慢反应速率但又不影响氢气生成的是( )
| A. | KOH | B. | CH3COONa | C. | CuSO4 | D. | Na2CO3 |
5.下列叙述中,正确的是( )
| A. | 两种粒子,若核外电子排布完全相同,则其化学性质相同 | |
| B. | 凡单原子形成的离子,一定具有稀有气体元素原子的核外电子排布 | |
| C. | 一种微粒与另一种微粒的质子数和电子数均相等,它们可能是一种离子和一种分子 | |
| D. | 不存在两种质子数和电子数均相同的阳离子和阴离子 |
2.下列物质中含有官能团种类最多的是( )
| A. |  | B. |  | ||
| C. |  | D. | CH2OH(CHOH)4CHO |
6.20世纪80年代中期,科学家发现并证明碳还以新的单质形态C60存在.后来人们又相继得到了C70、C76、C84、C90、C94等另外一些球碳分子.90年代初,科学家又发现了管状碳分子和洋葱状碳分子.(如图):下列说法错误的是( )
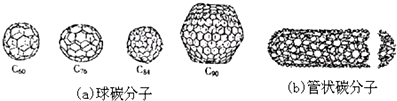

| A. | 金刚石和石墨的熔点肯定要比C60高 | |
| B. | 据估计C60熔点比金刚石和石墨要高 | |
| C. | 无论是球碳分子,还是管状碳分子、洋葱状碳分子,都应看作是碳的同素异形体 | |
| D. | C60的熔点低于C90 |
7.下列能作为比较氧元素和氯元素的非金属性强弱的是( )
| A. | H2SO4的酸性比HClO3酸性强 | |
| B. | Fe在纯氧中燃烧生成Fe3O4,Fe在氯气中燃烧生成FeCl3 | |
| C. | 在HClO中,元素化合价氯为+1价,氧为-2价 | |
| D. | O2为无色无味气体,Cl2为黄绿色有刺激性气味的气体 |

 +Br2$\stackrel{FeBr_{3}}{→}$
+Br2$\stackrel{FeBr_{3}}{→}$ +HBr;写出B盛AgNO3溶液的试管中所发生反应的化学方程式:HBr+AgNO3=AgBr↓+HNO3.
+HBr;写出B盛AgNO3溶液的试管中所发生反应的化学方程式:HBr+AgNO3=AgBr↓+HNO3. 下面给出了四种烃A、B、C、D的相关信息:
下面给出了四种烃A、B、C、D的相关信息: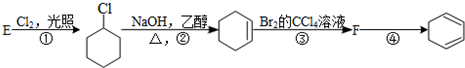
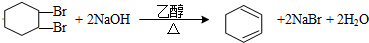 .
.