题目内容
10.甲同学计划用12mol•L-1的浓盐酸配制0.10mol•L-1的稀盐酸450mL.则他应量取浓盐酸的体积为4.1mL,应选用的量筒规格为10mL;乙同学要完成配制450mL0.40mol•L-1的NaOH溶液的实验,他应称取的NaOH固体的质量是8.0g.分析 配制0.10mol•L-1的稀盐酸450mL,实际上配制的是500mL 0.10mol/L的稀盐酸,根据配制过程中HCl的物质的量不变计算出需要12mol/L的浓盐酸的体积,根据计算结果判断量筒规格;配制450mL0.40mol•L-1的NaOH溶液,实际上配制的是500mL 0.40mol/L的氢氧化钠溶液,根据m=nM=cVM计算出需要氢氧化钠的质量.
解答 解:配制450mL稀盐酸,实际上配制的是500mL稀盐酸,配制过程中HCl的物质的量不变,则配制500mL 0.10mol/L的稀盐酸小于12mol/L的浓盐酸的体积为:$\frac{0.10mol/L×0.5L}{12mol/L}$≈0.0041L=4.1mL;量取4.1mL稀盐酸,应该选用10mL量筒;
配制450mL0.40mol•L-1的NaOH溶液,实际上配制的是500mL 0.40mol/L的氢氧化钠溶液,需要氢氧化钠的质量为:m(NaOH)=40g/mol×0.40mol/L×0.5L=8.0g,
故答案为:4.1mL;10mL;8.0.
点评 本题考查了物质的量的计算、配制一定物质的量浓度的溶液等知识,题目难度中等,明确配制一定物质的量浓度的溶液方法为解答关键,注意掌握物质的量与摩尔质量、物质的量浓度之间的关系为解答关键,试题培养了学生的化学计算能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
1.下列说法不正确的是( )
| A. | 有机化合物的1H核磁共振分析中,氢原子核所处的化学环境不同,表现出的核磁性就不同,代表核磁性特征的峰在核磁共振谱图中横坐标的位置也就不同 | |
| B. | 红外光谱是利用有机物分子中不同基团的特征吸收频率不同,测试并记录有机化合物对一定波长范围的红外光吸收情况,根据对红外光谱的分析,可以初步判断该有机化合物中具有哪些基团 | |
| C. | 有机化合物中的“基”是一成不变的 | |
| D. | 质谱法是用高能电子束轰击有机物分子,使之分离成带电的“碎片”,并根据“碎片”的某些特征谱分析有机物结构的方法 |
5.某学习小组研究铜片和酸反应的情况:
(1)在热水浴中进行3个实验,部分实验报告如下表所示
①实验Ⅰ、Ⅱ的目的是证明Cu不与H+、NO3-单独反应.
②实验Ⅲ中反应的本质是3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O(用离子方程式表示).
(2)甲同学提出:改变反应条件,可以实现金属铜和稀硫酸反应.
①将铜片放入盛有稀硫酸的烧杯中,不断向稀硫酸中加入过氧化氢并加热烧杯,发现铜片开始溶解,溶液逐渐变蓝色,过氧化氢在该实验中的作用是作氧化剂,将铜氧化为铜离子.
②利用电化学原理实现铜溶于稀硫酸并放出氢气.请画出简易装置图(标明电极,电解质溶液成分).
(1)在热水浴中进行3个实验,部分实验报告如下表所示
| 序号 | 实验操作 | 实验现象 |
| Ⅰ | 在稀硫酸中加铜片 | 无明显变化 |
| Ⅱ | 在硝酸钠溶液中加入铜片 | 无明显变化 |
| Ⅲ | 在稀硫酸中加入硝酸钠溶液 | 无明显变化 |
| 再加入铜片 | 有无色气泡;溶液变蓝色 |
②实验Ⅲ中反应的本质是3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O(用离子方程式表示).
(2)甲同学提出:改变反应条件,可以实现金属铜和稀硫酸反应.
①将铜片放入盛有稀硫酸的烧杯中,不断向稀硫酸中加入过氧化氢并加热烧杯,发现铜片开始溶解,溶液逐渐变蓝色,过氧化氢在该实验中的作用是作氧化剂,将铜氧化为铜离子.
②利用电化学原理实现铜溶于稀硫酸并放出氢气.请画出简易装置图(标明电极,电解质溶液成分).
10.现用浓度为0.1000mol/L的HCl溶液,测定某未知浓度的NaOH溶液:
(1)除锥形瓶外,下列实验仪器中不需要的是C.
A.滴定管B.铁架台C.容量瓶D.滴定管夹
(2)在锥形瓶中放入一定量的NaOH溶液,加入甲基橙或酚酞作为指示剂;当滴定达到终点后,蓝线的凹液面的最低点所对应的刻度即为终读数.
(3)填写下表中的空白处
(4)四组数据中,误差较大的是第1组,造成这种结果的原因可能是B.
A.滴定管未用HCl溶液润洗
B.摇晃锥形瓶时,有液体溅出
C.滴定前装HCl的滴定管下端有气泡,滴定后气泡消失
D.放入NaOH溶液前,锥形瓶内有水
(5)计算NaOH浓度平均值:0.1066mol/L.
(1)除锥形瓶外,下列实验仪器中不需要的是C.
A.滴定管B.铁架台C.容量瓶D.滴定管夹
(2)在锥形瓶中放入一定量的NaOH溶液,加入甲基橙或酚酞作为指示剂;当滴定达到终点后,蓝线的凹液面的最低点所对应的刻度即为终读数.
(3)填写下表中的空白处
| 实验次数 | V(NaOH) | V(HCl)/mL | c(NaOH) | ||
| ml | 初读数 | 终读数 | 体积 | mol/L | |
| 1 | 16.00 | 0.00 | 16.70 | 16.70 | 0.1044 |
| 2 | 16.75 | 0.00 | 17.85 | 17.85 | |
| 3 | 19.55 | 0.00 | 20.80 | 20.80 | 0.1064 |
| 4 | 15.00 | 0.00 | 16.00 | 16.00 | 0.1067 |
A.滴定管未用HCl溶液润洗
B.摇晃锥形瓶时,有液体溅出
C.滴定前装HCl的滴定管下端有气泡,滴定后气泡消失
D.放入NaOH溶液前,锥形瓶内有水
(5)计算NaOH浓度平均值:0.1066mol/L.
8.10ml浓度为1mol/L的盐酸与过量的锌粉反应,若加入适量的下列溶液,能减慢反应速率但又不影响氢气生成的是( )
| A. | KOH | B. | CH3COONa | C. | CuSO4 | D. | Na2CO3 |
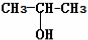 .
.