题目内容
4.在稀硫酸中加入铜粉,铜粉不溶解,再加入下列固体粉末:①FeCl2②Fe2O3③Zn④KNO3,铜粉可以溶解的是( )| A. | ①② | B. | ①④ | C. | ②④ | D. | ②③④ |
分析 Cu与稀硫酸不反应,因稀硫酸的氧化性较弱,则加具有氧化性的离子或物质可使铜反应而溶解,以此来解答.
解答 解:①因铜不如铁活泼,则铜不能与FeCl2反应,故①错误;
②因Fe2O3能与稀硫酸发生Fe2O3+3H2SO4═Fe2(SO4)3+3H2O,Fe2(SO4)3能与铜粉发生Fe2(SO4)3+Cu═2FeSO4+CuSO4,铜粉溶解,故②正确;
③Zn、Cu、H2SO4形成原电池,加快了反应,但发生的化学反应为Zn+H2SO4═ZnSO4+H2↑,Zn溶解,故③错误;
④因铜与稀HNO3反应,硝酸盐在酸性条件下具有硝酸的强氧化性,发生3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,可知Cu、H+、NO3-能发生氧化还原反应使Cu溶解,故④正确.
故选C.
点评 本题考查物质的性质及氧化还原反应,为高频考点,把握物质的性质、发生的反应为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案
相关题目
14.下列实验操作、现象和结论均正确的是( )
| 选项 | 实验操作 | 现象 | 结论 |
| A | 将一铝箔放在酒精灯外焰上灼烧 | 铝箔熔化但不滴落 | 铝箔表面生成致密的Al2O3薄膜,且Al2O3熔点高于Al |
| B | 向某氯化亚铁溶液中加入Na2O2粉末 | 出现红褐色沉淀 | 加入Na2O2粉末前,原氯化 亚铁溶液已经变质 |
| C | 铜放入稀硫酸中,再加入硝酸钠固体 | 开始无明显现象,后溶液变蓝,有明显的气泡放出,铜溶解 | 硝酸钠可以加快铜与稀硫酸的反应速率 |
| D |  | 烧杯中有白色胶状沉淀生成 | 非金属性:N>C>Si |
| A. | A | B. | B | C. | C | D. | D |
15.具有手性碳原子的物质具有旋光性,存在对映异构体,下列化合物中存在对映异构体的是( )
| A. | CH3CHClCH2CH3 | B. | CH3CH3 | C. | 甲烷 | D. | CH3COOH |
12.2015年巴黎气候变化大会召开,旨在保护环境造福人类.下列说法不正确的是( )
| A. | 扩大铅蓄电池、汞锌锰干电池的生产,满足消费需求 | |
| B. | 采用碳捕集和储存技术,逐步实现二氧化碳的零排放 | |
| C. | 对工业废水、生活污水净化处理,减少污染物的排放 | |
| D. | 催化处理汽车尾气,减轻氮氧化物污染和光化学烟雾 |
19.下列化合物不能由单质直接化合得到的是( )
| A. | CuCl2 | B. | FeCl2 | C. | HCl | D. | Na2O2 |
9.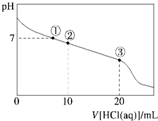 常温下,向20.00mL 0.100mol•L-1 CH3COONa溶液中逐滴加入0.100 0mol•L-1盐酸,溶液的pH与所加盐酸体积的关系如图所示(不考虑挥发).下列说法正确的( )
常温下,向20.00mL 0.100mol•L-1 CH3COONa溶液中逐滴加入0.100 0mol•L-1盐酸,溶液的pH与所加盐酸体积的关系如图所示(不考虑挥发).下列说法正确的( )
 常温下,向20.00mL 0.100mol•L-1 CH3COONa溶液中逐滴加入0.100 0mol•L-1盐酸,溶液的pH与所加盐酸体积的关系如图所示(不考虑挥发).下列说法正确的( )
常温下,向20.00mL 0.100mol•L-1 CH3COONa溶液中逐滴加入0.100 0mol•L-1盐酸,溶液的pH与所加盐酸体积的关系如图所示(不考虑挥发).下列说法正确的( )| A. | 点①所示溶液中:c(CH3COOH)=c(Cl-)>c(OH-)=c(H+) | |
| B. | 点②所示溶液中:c(Na+)>c(Cl-)>c(CH3COO-)>c(CH3COOH) | |
| C. | 点③所示溶液中:c(CH3COOH)>c(Na+)>c(H+)>c(CH3COO-) | |
| D. | 整个过程中可能出现:c(H+)+c(Na+)═c(CH3COOH)+c(CH3COO-) |
16.据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十倍,可连续使用一个月才充一次电.其电池反应为:
2CH3OH+3O2+4OH-$?_{充电}^{放电}$ 2CO32-+6H2O则下列说法错误的( )
2CH3OH+3O2+4OH-$?_{充电}^{放电}$ 2CO32-+6H2O则下列说法错误的( )
| A. | 放电时CH3OH参与反应的电极为正极 | |
| B. | 充电时电解质溶液的pH逐渐增大 | |
| C. | 放电时负极的电极反应为:2CH3OH-12e-+16OH-═2CO32-+12H2O | |
| D. | 充电时每生成1 mol CH3OH转移6 mol电子 |
13.由MgO、A12O3、SiO2、Fe2O3组成的混合粉末.现取一份该混合粉末试样进行实验,首先将其溶于过量的盐酸,过滤后,得到沉淀X和滤液Y.下列叙述正确的是( )
| A. | 从组成看,其成分皆是碱性氧化物 | |
| B. | 沉淀X的成分是SiO2 | |
| C. | 溶液Y中的阳离子主要是Mg2+、Fe3+、H+ | |
| D. | 在溶液Y中加入过量NaOH溶液,先产生沉淀后全部溶解 |
14.下列关于同分异构体数目的叙述中不正确的是( )
| A. | 甲苯苯环上的一个氢原子被含3个碳原子的烷基取代所得产物有6种 | |
| B. | 与 互为同分异构体的芳香族化合物有6种 互为同分异构体的芳香族化合物有6种 | |
| C. | 2-甲基丁烷的一氯取代物共有4种 | |
| D. | 菲的结构简式为 ,它的一硝基取代物有5种 ,它的一硝基取代物有5种 |