题目内容
9.下列实验或操作合理的是( )| A. |  制氨气 | B. |  蒸发、浓缩、结晶 | ||
| C. |  制备并收集少了二氧化氮 | D. |  浓硫酸稀释 |
分析 A.CaO和水反应是放热反应,一水合氨分解是吸热反应,所以可以用浓氨水和CaO混合制取氨气,根据氨气密度和性质选取合适的收集方法;
B.用于蒸发浓缩、冷却结晶的仪器是蒸发皿;
C.二氧化氮气体能溶于水,不能采用排水法收集;
D.容量瓶只能配制一定物质的量浓度溶液,但不能稀释或溶解药品.
解答 解:A.CaO和水反应是放热反应,一水合氨分解是吸热反应,所以可以用浓氨水和CaO混合制取氨气,氨气密度小于空气且常温下和空气不反应,所以可以采用向下排空气法收集,故A正确;
B.用于蒸发浓缩、冷却结晶的仪器是蒸发皿,坩埚用于高温灼烧固体药品,故B错误;
C.二氧化氮气体能溶于水,不能采用排水法收集,应该采用向上排空气法收集,故C错误;
D.容量瓶只能配制一定物质的量浓度溶液,但不能稀释或溶解药品,应该用烧杯稀释浓硫酸,将溶液冷却至室温后再转移到容量瓶中,故D错误;
故选A.
点评 本题考查化学实验方案评价,为高频考点,涉及气体制取和收集、溶液配制、仪器的选取等知识点,明确实验原理、实验基本操作方法、仪器的用途等是解本题关键,注意容量瓶的用途及规格,题目难度不大.

练习册系列答案
相关题目
19.实验室用如图所示装置制备氯气并进行一系列相关的实验(夹持设备已省略).
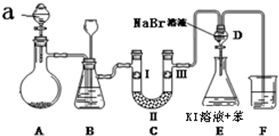
(1)a仪器的名称是:分液漏斗.
(2)洗气装置B是为了除去Cl2中的HCl气体,应放入的试剂是饱和食盐水;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象:B中长颈漏斗中液面上升,形成水柱.
(3)制备氯气选用的药品为:漂粉精固体(主要成分为Ca(ClO)2).和浓盐酸,写出反应的化学反应方程式Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O.
(4)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、Ⅱ、Ⅲ依次放入(填符号)c.
(5)设计装置D、E的目的是比较氯、溴、碘的非金属性.当向D中缓缓通入一定量氯气时,可以看到无色溶液逐渐变为黄色,说明非金属性氯大于溴(填“大于”或“小于”).
(6)打开活塞,将装置D中少量溶液加入装置E中,振荡.观察到的现象是E中溶液分为两层,上层(苯层、油层或有机层均可)为紫红色.
(7)F处为尾气吸收装置,写出实验室利用烧碱溶液吸收Cl2的离子方程式Cl2+2OH-=Cl-+ClO-+H2O.

(1)a仪器的名称是:分液漏斗.
(2)洗气装置B是为了除去Cl2中的HCl气体,应放入的试剂是饱和食盐水;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象:B中长颈漏斗中液面上升,形成水柱.
(3)制备氯气选用的药品为:漂粉精固体(主要成分为Ca(ClO)2).和浓盐酸,写出反应的化学反应方程式Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O.
(4)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、Ⅱ、Ⅲ依次放入(填符号)c.
| a | b | c | d | |
| I | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 硅胶 | 无水氯化钙 | 浓硫酸 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(6)打开活塞,将装置D中少量溶液加入装置E中,振荡.观察到的现象是E中溶液分为两层,上层(苯层、油层或有机层均可)为紫红色.
(7)F处为尾气吸收装置,写出实验室利用烧碱溶液吸收Cl2的离子方程式Cl2+2OH-=Cl-+ClO-+H2O.
17.可逆反应mA(s)+nB(g)?cC(g)+fD(g)反应过程中,当其它条件不变时,C的体积分数(C%)与温度(T)和压强(p)的关系如下图所示(T2>T1),下列叙述错误的是( )


| A. | 达到化学平衡后,增加A的量有利于化学平衡向正反应方向移动 | |
| B. | 达到平衡后,若使温度升高,化学平衡向逆反应方向移动 | |
| C. | 化学方程式中n<c+f | |
| D. | 达到平衡后,若使用催化剂,C的体积分数不变 |
14.设NA为阿伏加德罗常数的值,下列有关叙述不正确的是( )
| A. | 1 mol乙炔分子所含的共用电子对总数为5NA | |
| B. | 1 mol甲基(-CH3 )所含的电子总数为9NA | |
| C. | 0.5 mol 1,3-丁二烯分子中含有碳碳双键总数为NA | |
| D. | 标准状况下,22.4L己烷完全燃烧所生成的气态产物的分子数为7NA |
18.以下关于化学实验中“先”与“后”的说法正确的是( )
①加热试管时,先均匀加热,后局部加热
②做H2还原CuO实验时,先通H2,后加热CuO,反应完毕后,先撤酒精灯待试管冷却,后停止通H2
③制取气体时,先检查装置气密性,后装药品
④点燃可燃性气体如H2、CO等时,先检验气体纯度,后点燃
⑤制取蒸馏水时,先通冷却水,后加热烧瓶
⑥进行分液操作时,先从上口倒出上层液体,后从通过下端活塞放出下层液体.
①加热试管时,先均匀加热,后局部加热
②做H2还原CuO实验时,先通H2,后加热CuO,反应完毕后,先撤酒精灯待试管冷却,后停止通H2
③制取气体时,先检查装置气密性,后装药品
④点燃可燃性气体如H2、CO等时,先检验气体纯度,后点燃
⑤制取蒸馏水时,先通冷却水,后加热烧瓶
⑥进行分液操作时,先从上口倒出上层液体,后从通过下端活塞放出下层液体.
| A. | ①②③④ | B. | ①②③④⑤ | C. | ①②③④⑥ | D. | 全部 |
13.某无色、澄清溶液中可能含有①Na+、②SO42-、③Cl-、④HCO3-、⑤CO32-、⑥H+、⑦Cu2+中的若干种,依次进行下列实验,且每步所加试剂均过量,观察到的现象如表.下列结论正确的是( )
| 步骤 | 操作 | 现象 |
| (1) | 用紫色石蕊试液检验 | 溶液变红 |
| (2) | 向溶液中滴加BaCl2和稀HCl | 有白色沉淀生成 |
| (3) | 将(2)中所得混合物过滤,向滤液中加入AgNO3溶液和稀HNO3 | 有白色沉淀生成 |
| A. | 肯定含有的离子是②③⑥ | B. | 肯定没有的离子是④⑤ | ||
| C. | 可能含有的离子是①③ | D. | 可能含有的离子是① |

 D 的原子结构示意图
D 的原子结构示意图 .
.