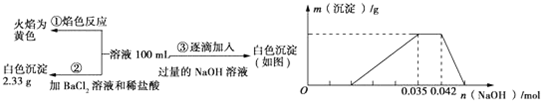
题目内容
4.实验室里常用浓盐酸与二氧化锰反应来制取少量的氯气,反应的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.取一定量的浓盐酸使其与二氧化锰发生反应,产生的氯气在标准状况下的体积为22.4L.请回答下列问题:
(1)求参加反应的二氧化锰的质量.
(2)求反应中被氧化的HCl的物质的量.
(3)实验室备用的浓盐酸质量分数为36.5%,密度为1.19g•cm-3,求该浓盐酸中HCl的物质的量浓度.
分析 根据n=$\frac{V}{{V}_{m}}$计算标准状况下22.4L氯气的物质的量,
(1)根据方程式定比关系计算参加反应二氧化锰的物质的量,根据m=nM计算二氧化锰的质量;
(2)根据方程式定比关系计算参加反应的HCl的物质的量;
(3)根据c=$\frac{1000ρw}{M}$计算该浓盐酸的物质的量浓度.
解答 解:标准状况下22.4L氯气的物质的量1mol,
(1)令参加反应二氧化锰的物质的量为xmol,则:
MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ MnCl2+Cl2↑+2H2O
1mol 1mol
xmol 1mol
故x=1,故参加反应二氧化锰的质量为1mol×87g/mol=87g,
答:参加反应的二氧化锰的质量为87g;
(2)令参加反应的HCl的物质的量为ymol,则:
MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ MnCl2+Cl2↑+2H2O
4mol 1mol
ymol 1mol
故y=4mol,被氧化的HCl的物质的量为2mol,
答:被氧化的HCl的物质的量为2mol;
(3)该浓盐酸的物质的量浓度=$\frac{1000×1.19×36.5%}{36.5}$mol/L=11.9mol/L,
答:该浓盐酸的物质的量浓度为11.9mol/L.
点评 本题考查根据方程式的计算、物质的量浓度计算,难度不大,(3)注意掌握物质的量浓度与质量分数的关系.

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目
14.相同温度、相同浓度的六种电解质溶液,其pH由小到大的顺序如图所示,图中①②③代表的物质可能分别是( )
| A. | CH3COOH HCl CH3COONa | B. | HCl CH3COOH NaHCO3 | ||
| C. | NH4Cl CH3COOH NaOH | D. | NH4Cl HCl CH3COONa |
15.下列反应过程需要吸收热量的是( )
| A. | 燃烧 | B. | 浓硫酸溶于水 | C. | 酸碱中和 | D. | 水的电离 |
12.下列关于反应2Na2O2+2H2O═4NaOH+O2↑的说法正确的是( )
| A. | 过氧化钠是氧化剂,水是还原剂 | B. | Na2O2是还原剂,水是氧化剂 | ||
| C. | 过氧化钠既是氧化剂又是还原剂 | D. | 水既是氧化剂又是还原剂 |
9.下列实验或操作合理的是( )
| A. |  制氨气 | B. |  蒸发、浓缩、结晶 | ||
| C. |  制备并收集少了二氧化氮 | D. |  浓硫酸稀释 |
13.要使K2S溶液中$\frac{c({K}^{+})}{c({S}^{2-})}$的比值变大,可加入适量的物质是( )
| A. | 盐酸 | B. | KHS溶液 | C. | NaOH溶液 | D. | Na2S溶液 |