题目内容
7.以有机物A为原料合成重要精细化工中间体TMBA( )和抗癫痫药物H(
)和抗癫痫药物H(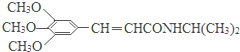 )的路线如图(部分反应略去条件和试剂):
)的路线如图(部分反应略去条件和试剂):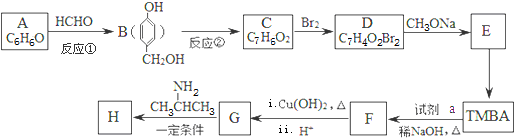
已知:I.RONa+R′X→ROR′+NaX;
II.
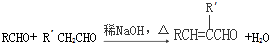 (R、R′表示烃基或氢)
(R、R′表示烃基或氢)(1)A的名称是苯酚;C能发生银镜反应,则C分子中含氧官能团的名称是羟基、醛基.
(2)①和②的反应类型分别是加成反应、氧化反应.
(3)E的结构简式是
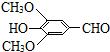 ,试剂a的分子式是C2H4O.
,试剂a的分子式是C2H4O.(4)C→D的化学方程式是
 +2Br2→
+2Br2→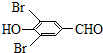 +2HBr.
+2HBr.(5)D的同分异构体有多种,其中属于芳香族酯类化合物的共有6种.
(6)F与新制Cu(OH)2悬浊液发生反应的化学方程式是
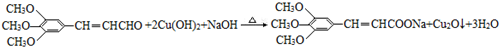 .
.(7)已知酰胺键(
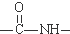 )有类似酯基水解的性质,写出抗癫痫病药物H与足量NaOH溶液发生反应的化学方程式
)有类似酯基水解的性质,写出抗癫痫病药物H与足量NaOH溶液发生反应的化学方程式 +NaOH→
+NaOH→ +H2NCH(CH3)2.
+H2NCH(CH3)2.
分析 A的分子式为C6H6O,而能与HCHO反应生成B,由B的结构可知A为 ;B的分子式为C7H8O2,生成的C的分子式为C7H6O2,则反应②为羟基氧化为醛基,则C的结构简式为:
;B的分子式为C7H8O2,生成的C的分子式为C7H6O2,则反应②为羟基氧化为醛基,则C的结构简式为: ,C与溴发生酚羟基邻位取代生成D为
,C与溴发生酚羟基邻位取代生成D为 ,由信息I中的反应可知,D与甲醇钠反应生成E为
,由信息I中的反应可知,D与甲醇钠反应生成E为 .由H的结构可知G为
.由H的结构可知G为 ,逆推可知F为
,逆推可知F为 ,结合信息II可知,TMBA与CH3CHO在碱性条件下生成F,据此解答.
,结合信息II可知,TMBA与CH3CHO在碱性条件下生成F,据此解答.
解答 解:A的分子式为C6H6O,而能与HCHO反应生成B,由B的结构可知A为 ;B的分子式为C7H8O2,生成的C的分子式为C7H6O2,则反应②为羟基氧化为醛基,则C的结构简式为:
;B的分子式为C7H8O2,生成的C的分子式为C7H6O2,则反应②为羟基氧化为醛基,则C的结构简式为: ,C与溴发生酚羟基邻位取代生成D为
,C与溴发生酚羟基邻位取代生成D为 ,由信息I中的反应可知,D与甲醇钠反应生成E为
,由信息I中的反应可知,D与甲醇钠反应生成E为 .由H的结构可知G为
.由H的结构可知G为 ,逆推可知F为
,逆推可知F为 ,结合信息II可知,TMBA与CH3CHO在碱性条件下生成F,
,结合信息II可知,TMBA与CH3CHO在碱性条件下生成F,
(1)由上述分析可知,A为 ,名称为苯酚,C的结构简式为:
,名称为苯酚,C的结构简式为: C分子中含氧官能团的名称是:羟基、醛基,
C分子中含氧官能团的名称是:羟基、醛基,
故答案为:苯酚;羟基、醛基;
(2)反应①的反应物为苯酚和甲醛,生成物为B,对比结构可知反应①为加成反应;反应②为醇羟基氧化为醛基,
故答案为:加成反应;氧化反应;
(3)由上述分析可知,E的结构简式为 ,试剂a为CH3CHO,的分子式是C2H4O,
,试剂a为CH3CHO,的分子式是C2H4O,
故答案为: ;C2H4O;
;C2H4O;
(4)C→D的化学方程式是: +2Br2→
+2Br2→ +2HBr,
+2HBr,
故答案为: +2Br2→
+2Br2→ +2HBr;
+2HBr;
(5)D为 ,属于芳香族酯类化合物一定含有-OOCH,2个Br原子相邻时,-OOCH有2种位置,2个Br原子相间时,-OOCH有3种位置,2个Br原子相对时,-OOCH有1种位置,故共有2+3+1=6种,
,属于芳香族酯类化合物一定含有-OOCH,2个Br原子相邻时,-OOCH有2种位置,2个Br原子相间时,-OOCH有3种位置,2个Br原子相对时,-OOCH有1种位置,故共有2+3+1=6种,
故答案为:6;
(6)F为 ,与新制Cu(OH)2悬浊液发生反应的化学方程式是:
,与新制Cu(OH)2悬浊液发生反应的化学方程式是: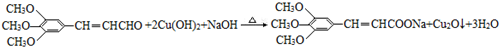 ,
,
故答案为: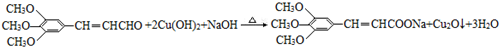 .
.
(7)抗癫痫病药物H含有酰胺键,在NaOH条件下发生水解,则反应的化学方程式为: +NaOH→
+NaOH→ +H2NCH(CH3)2,
+H2NCH(CH3)2,
故答案为: +NaOH→
+NaOH→ +H2NCH(CH3)2.
+H2NCH(CH3)2.
点评 本题考查有机合成与推断、同分异构体的判断、有机反应类型、化学方程式的书写,是对有机化学基础的综合考查,注意充分利用TMBA与H的结构、有机物分子式推断,较好的考查学生分析推理能力,难度中等.

| A. | 氢的五种同位素 | B. | 五种氢元素 | ||
| C. | 都不带电荷的粒子 | D. | 氢元素的五种不同粒子 |
| A. | H2O2的电子式: | B. | 次氯酸的结构式:H-O-Cl | ||
| C. | S2-的结构示意图: | D. | CO2的比例模型: |
 常温下,向100mL0.1mol/LNH4HSO4溶液中滴加0.1mol/L的NaOH溶液,所得溶液PH与NaOH溶液体积的关系曲线如图所示,下列说法正确的是( )
常温下,向100mL0.1mol/LNH4HSO4溶液中滴加0.1mol/L的NaOH溶液,所得溶液PH与NaOH溶液体积的关系曲线如图所示,下列说法正确的是( )| A. | a、b、c、d四个点中,水的电离程度最大的是d | |
| B. | a点溶液中:c(NH3•H2O)+c(H+)═c(OH-) | |
| C. | b点溶液中:c(Na+)+c(NH4+)═2c(SO42-) | |
| D. | c点溶液中:c(Na+)═c(SO42-)+c(NH4+)+c(NH3•H2O) |
 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下①将碱式滴定管用蒸馏水洗净后,用待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入25.00mL待测溶液到锥形瓶中.
②将酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000mol/L标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数.
③向锥形瓶中滴入酚酞作指示剂,进行滴定.滴定至指示剂刚好变色,且并不马上变色为止,测得所耗盐酸的体积为V1mL.
④重复以上过程,但在滴定过程中向锥形瓶加入5mL的蒸馏水,测得所耗盐酸的体积为V2mL.试回答下列问题:
(1)滴定终点的现象:当滴入最后一滴盐酸时,锥形瓶中的溶液从红色变为无色,且半分钟内不变色
(2)滴定时边滴边摇动锥形瓶,眼睛应观察B
A、滴定管内液面的变化 B、锥形瓶内溶液颜色的变化
(3)该小组在步骤①中的错误是用待测溶液润洗锥形瓶由此造成的测定结果偏高(偏高、偏低或无影响)
(4)步骤②缺少的操作是酸式滴定管用蒸馏水洗净后,应用标准液润洗
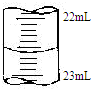
(5)如图是某次滴定时的滴定管中的液面,其读数为22.60mL
(6)根据下列数据:
| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 25.00 | 0.50 | 20.40 |
| 第二次 | 25.00 | 4.00 | 24.10 |
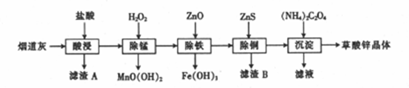
有关氢氧化物开始沉淀和沉淀完全的pH如下表:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
| 开始沉淀时的pH | 1.9 | 6.5 | 4.2 | 5.4 |
| 完全沉淀时的pH | 3.3 | 9.7 | 6.7 | 8.2 |
(1)滤渣A的主要成分为SiO2(填化学式).
(2)生成滤渣B的离子方程式为ZnS+Cu2+=CuS+Zn2+.
(3)除铁时加入ZnO控制反应液的pH范围为3.3~5.4.
(4)该炼锌厂废气中含有H2S,可用FeCl3溶液吸收H2S,得到单质硫,过滤后,再以石墨为电极,在一定条件下电解滤液.
①FeCl3与H2S反应的离子方程式为2Fe3++H2S=2Fe2++S↓+2H+.
②电解池中阴极的电极反应式为2H+-2e-=H2↑.
(5)25℃时,向0.10mol•L-1的H2S溶液中通入HCl气体或加入NaOH固体以调节溶液pH与c(S2-)的关系如图2所示(忽略溶液体积的变化和H2S的挥发)
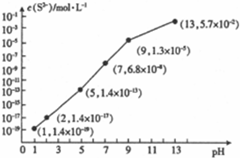
①pH=13时,溶液中的c(H2S)+c(HS-)=0.043mol•L-1
②某溶液中含未知浓度的Mn2+、0.01mol•L-1Fe2+和0.10mol•L-1H2S,当溶液pH=2时,Fe2+ 开始沉淀,当Mn2+开始沉淀时,溶液中
$\frac{c(M{n}^{2+})}{c(F{e}^{2+})}$=2×106.