题目内容
18.${\;}_{1}^{1}$H、${\;}_{1}^{2}$H、${\;}_{1}^{3}$H、H+、H2是( )| A. | 氢的五种同位素 | B. | 五种氢元素 | ||
| C. | 都不带电荷的粒子 | D. | 氢元素的五种不同粒子 |
分析 A、质子数相同,中子数不同的同一元素的不同原子互称同位素;
B、元素为质子数相同中子数不同一类原子的总称;
C、H+为离子,带正电荷;
D、是五种不同微粒.
解答 解:A、同位素是原子而言的,H+为离子,H2为单质,故A错误;
B、元素为质子数相同中子数不同一类原子的总称,是氢元素的形成不同微粒,故B错误;
C、H+为离子,带正电荷,故C错误;
D、是氢元素的形成不同微粒,故D正确.
故选D.
点评 本题考查同位素、元素、核素等基本概念,难度较小,掌握好概念即可容易解答.

练习册系列答案
 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案
相关题目
9.下列物质的分离提纯所用的方法不正确的是( )
| A. | 酒精和水:分液 | |
| B. | 淀粉溶液(胶体)中混有氯化钠:用半透膜进行渗析 | |
| C. | 汽油和柴油:分馏 | |
| D. | 三氯甲烷和水:分液 |
13.区别硫酸铜溶液和氢氧化铁胶体最简单的方法是( )
| A. | 丁达尔效应 | B. | 观察溶液颜色 | C. | 过滤 | D. | 加热 |
3.人们习惯上把金、银、铜、铁、锡五种金属统称为“五金”;在常温下,下列可以盛放在铁制容器中的物质是( )
| A. | 浓H2SO4 | B. | 稀HNO3 | C. | 盐酸 | D. | CuSO4溶液 |
10.反应4NH3+5O2=4NO+6H2O 在5L的密闭容器中进行,30s后,NO的物质的量增加了0.3mol,则此反应的平均速率可表示为( )
| A. | v(O2)=0.0025 mol/(L•s) | B. | v(NO)=0.008 mol/(L•s) | ||
| C. | v(H2O)=0.003 mol/(L•s) | D. | v(NH3)=0.002 mol/(L•s) |
19.将一定量的镁和铜组成的混合物加入到稀硝酸中,金属完全溶解(假设反应中还原产物只有NO).向反应后的溶液中加入3mol/L NaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1g.下列叙述不正确的是( )
| A. | 当生成的沉淀量达到最大时,消耗NaOH溶液的体积V≥100 mL | |
| B. | 当金属全部溶解时收集到NO气体的体积一定为2.24 L | |
| C. | 参加反应的金属的总质量3.6 g<m<9.6 g | |
| D. | 当金属全部溶解时,参加反应的硝酸的物质的量一定是0.4 mol |
 )和抗癫痫药物H(
)和抗癫痫药物H(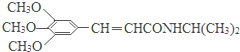 )的路线如图(部分反应略去条件和试剂):
)的路线如图(部分反应略去条件和试剂):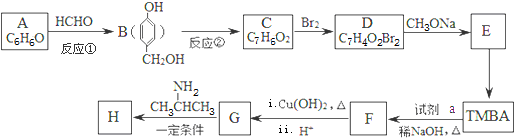
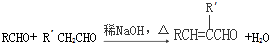 (R、R′表示烃基或氢)
(R、R′表示烃基或氢)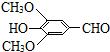 ,试剂a的分子式是C2H4O.
,试剂a的分子式是C2H4O. +2Br2→
+2Br2→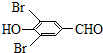 +2HBr.
+2HBr.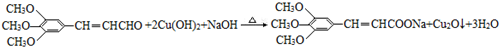 .
.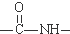 )有类似酯基水解的性质,写出抗癫痫病药物H与足量NaOH溶液发生反应的化学方程式
)有类似酯基水解的性质,写出抗癫痫病药物H与足量NaOH溶液发生反应的化学方程式 +NaOH→
+NaOH→ +H2NCH(CH3)2.
+H2NCH(CH3)2.