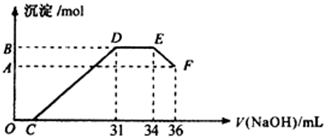
题目内容
16.下列八种物质:①丙烯、②甲苯、③聚氯乙烯、④聚异戊二烯、⑤丙炔、⑥环己烷、⑦环己烯、⑧溴乙烷中既能使酸性高锰酸钾溶液褪色,又能使溴水因反应而褪色的是( )| A. | ①③④⑤⑦ | B. | ④⑤⑦ | C. | ④⑤ | D. | ①④⑤⑦ |
分析 既能使酸性高锰酸钾溶液褪色,又能使溴水因反应而褪色,则有机物中含碳碳双键、碳碳三键,以此来解答.
解答 解:①丙烯、④聚异戊二烯、⑦环己烯均含碳碳双键,⑤丙炔含碳碳三键,则均既能使酸性高锰酸钾溶液褪色,又能使溴水因反应而褪色,
而②甲苯、③聚氯乙烯、⑥环己烷、⑧溴乙烷均与溴水不反应,
故选D.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重分析与应用能力的考查,注意烯烃、炔烃的性质,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
6.以葡萄糖为燃料的微生物燃料电池结构示意图如图所示.关于该电池的叙述不正确的是( )
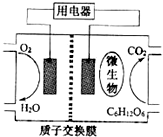

| A. | 该电池能够在高温下工作 | |
| B. | 电池的负极反应为:C6H12O6+6H2O-24e-═6CO2+24H+ | |
| C. | 放电过程中,质子(H+)从负极区向正极区迁移 | |
| D. | 在电池反应中,每消耗1mol氧气,理论上能生成标准状况下CO2气体22.4 L |
7.下列晶体熔化时不需要破坏化学键的是( )
| A. | 金刚石 | B. | 氟化镁 | C. | 冰 | D. | 金属钾 |
4.有关金属晶体的说法不正确的是( )
| A. | 金属Cu的晶体的配位数为12 | |
| B. | 金属键是金属阳离子与自由电子间的相互作用 | |
| C. | 金属的延展性可以用电子气理论解释 | |
| D. | 金属Mg、Zn、Ti都是六方最密堆积,空间利用率是68% |
11.已知 X、Y、Z、M、R五种元素中,原子序数X<Y<Z<M<R,其结构或性质信息如下表.请根据信息回答有关问题:
(1)元素M的原子核外共有17种不同运动状态的电子,有5种不同能级的电子.
(2)X、Y、Z三种元素的第一电离能较高的是N(写元素符号),原因是N原子的2p能级电子为半充满,为较稳定的结构.
(3)R的一种配合物的化学式为RCl3•6H2O.已知0.01molRCl3•6H2O在水溶液中用过量硝酸银溶液处理,产生0.02mol AgCl沉淀.此配合物最可能是B.
A.[R(H2O)6]Cl3 B.[R(H2O)5Cl]Cl2•H2O C.[R(H2O)4Cl2]Cl•2H2O D.[R(H2O)3Cl3]•3H2O.
| 元素 | 结构或性质信息 |
| X | 原子的L层上s电子数等于p电子数. |
| Y | 原子核外的L层有3个未成对电子. |
| Z | 在元素周期表的各元素中电负性仅小于氟. |
| M | 单质常温、常压下是气体,原子的M层上有1个未成对的p电子. |
| R | 第四周期过渡元素,其价电子层各能级处于半充满状态 |
(2)X、Y、Z三种元素的第一电离能较高的是N(写元素符号),原因是N原子的2p能级电子为半充满,为较稳定的结构.
(3)R的一种配合物的化学式为RCl3•6H2O.已知0.01molRCl3•6H2O在水溶液中用过量硝酸银溶液处理,产生0.02mol AgCl沉淀.此配合物最可能是B.
A.[R(H2O)6]Cl3 B.[R(H2O)5Cl]Cl2•H2O C.[R(H2O)4Cl2]Cl•2H2O D.[R(H2O)3Cl3]•3H2O.
1.化学和科学、技术、社会、环境密切相关.下列有关说法中错误的是( )
| A. | 节日焰火是某些金属元素焰色反应所呈现出来的色彩 | |
| B. | 生活中常用的塑料制品及橡胶制品都为高分子材料 | |
| C. | 向牛奶中加入果汁会产生沉淀,这是因为酸碱发生了中和反应 | |
| D. | 可用蘸浓盐酸的棉棒检验输送氨气的管道是否漏气 |
 .
. .
.