题目内容
18.如图表示从固体混合物中分离X的2种方案,请根据方案Ⅰ与方案Ⅱ指出下列说法不合理的是( )
| A. | 可以选用方案Ⅰ分离NaCl中的I2 | |
| B. | 方案Ⅰ中X物质不可能是受热易分解的物质 | |
| C. | 方案Ⅱ中加入NaOH溶液可以分离出含SiO2的Fe2O3 | |
| D. | 方案Ⅱ中加入的也可以是能够溶解除X外的其余物质的试剂 |
分析 A.碘易升华;
B.方案Ⅰ中采用加热法,则易分解的物质(或易升华)能与不易分解的物质分离;
C.SiO2能与NaOH溶液反应;
D.方案Ⅱ中X以沉淀形式存在,则加入的物质能溶解除X外的其余物质.
解答 解:A.因碘易升华,可用加热的方法除杂,故A正确;
B.方案Ⅰ中采用加热法,则易分解的物质(或易升华)能与不易分解的物质分离,则X物质可能是受热易分解的物质,故B错误;
C.SiO2能与NaOH溶液反应,而Fe2O3不能与NaOH溶液反应,则案Ⅱ中加入NaOH溶液可以分离出含SiO2的Fe2O3,故C正确;
D.方案Ⅱ中过滤操作可知,X以沉淀形式存在,则加入的物质能溶解除X外的其余物质,故D正确;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,侧重物质性质及化学反应的考查,注意把握的性质的差异,注意实验的评价性、操作性分析,题目难度不大.

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案
相关题目
8.在电解冶炼铝的电解槽中存在电解质W2[X2Y2Z4].已知其涉及的四种元素的简单离子的电子层结构均相同,
Y原子最外层电子数为次外层的3倍,X原子最外层电子数为Y原子最外层电子数的一半.下列说法正确的是
( )
Y原子最外层电子数为次外层的3倍,X原子最外层电子数为Y原子最外层电子数的一半.下列说法正确的是
( )
| A. | 原子序数:W>X>Y>Z | B. | 原子半径:W>X>Y>Z | ||
| C. | 最高价氧化物对应的碱的碱性:W<X | D. | 最简单氧化物的稳定性:Y>Z |
9.下列有关晶体的叙述中,错误的是( )
| A. | 金刚石网状结构中,由共价键形成的碳原子环中,最小的环上有6个碳原子 | |
| B. | 氯化钠晶体中,每个Na+周围距离相等且最近的Na+共有6个 | |
| C. | 金属晶体中,铜和锌都是面心立方堆积 | |
| D. | 干冰晶体中,每个CO2分子周围距离相等且最近的CO2分子共有12个 |
6.以葡萄糖为燃料的微生物燃料电池结构示意图如图所示.关于该电池的叙述不正确的是( )
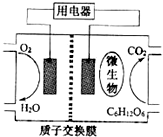

| A. | 该电池能够在高温下工作 | |
| B. | 电池的负极反应为:C6H12O6+6H2O-24e-═6CO2+24H+ | |
| C. | 放电过程中,质子(H+)从负极区向正极区迁移 | |
| D. | 在电池反应中,每消耗1mol氧气,理论上能生成标准状况下CO2气体22.4 L |
7.下列晶体熔化时不需要破坏化学键的是( )
| A. | 金刚石 | B. | 氟化镁 | C. | 冰 | D. | 金属钾 |

 ;D元素在元素周期表中的位置为第四周期第Ⅷ族
;D元素在元素周期表中的位置为第四周期第Ⅷ族
 .
. .
.