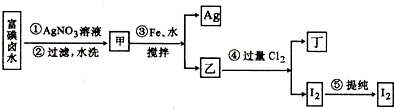
题目内容
6.在298K、1.01×105 Pa下,将22gCO2通入750mL 1mol•L-1 NaOH 溶液中充分反应,测得反应放出x kJ的热量.已知在该条件下,1molCO2通入1L2mol•L-1 NaOH溶液中充分反应放出y kJ的热量,则CO2与NaOH溶液反应生成NaHCO3的热化学方程式正确的是( )| A. | CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(2y-x) kJ•mol-1 | |
| B. | CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(2x-y) kJ•mol-1 | |
| C. | CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(4x-y) kJ•mol-1 | |
| D. | CO2(g)+2NaOH(l)═2NaHCO3(l)△H=-(8x-2y) kJ•mol-1 |
分析 根据题意可知,22gCO2通入1mol•L-1NaOH溶液750mL中充分反应,测得反应放出xkJ的热量,写出热化学反应方程式,再利用1mol CO2通入2mol•L-1NaOH溶液2L中充分反应放出y kJ的热量写出热化学反应方程式,最后利用盖斯定律来书写CO2与NaOH溶液反应生成NaHCO3的热化学方程式.
解答 解:根据题意,22gCO2通入1mol•L-1NaOH溶液750mL中充分反应,n(CO2)=$\frac{22g}{44g/mol}$=0.5mol,n(NaOH)=1mol•L-1×0.75L=0.75mol,
该反应既生成碳酸钠又生成碳酸氢钠,方程式为2CO2+3NaOH═NaHCO3+Na2CO3+H2O,
由0.5molCO2反应放出热量为xKJ,则2molCO2反应放出热量为4xKJ,即热化学反应方程式为
2CO2(g)+3NaOH(aq)═NaHCO3 (aq)+Na2CO3(aq)+H2O(l)△H=-4xKJ/mol①,
又1mol CO2通入2mol•L-1NaOH溶液2L中充分反应放出y kJ的热量,则热化学方程式为
2NaOH(aq)+CO2(g)═Na2CO3(aq)+H2O(l)△H=-yKJ/mol②,
由盖斯定律可知,①-②可得,NaOH(aq)+CO2(g)═NaHCO3(aq)△H=-(4x-y)KJ/mol,
故选C.
点评 本题考查热化学方程式的书写和计算,是高考中常见题型,计算中涉及到化学方程式的有关计算问题和盖斯定律的有关应用,是一重点题型,学生还应注意在书写热化学方程式时标明各物质的状态.

练习册系列答案
相关题目
16.每年6月5日为世界环境日.下列有关环保建议不能采纳的是( )
| A. | 开发利用太阳能 | B. | 提倡垃圾分类处理 | ||
| C. | 改进汽车尾气净化技术 | D. | 将工业废水直接排放 |
1.电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀.Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.某科研小组用电浮选凝聚法处理污水,设计装置示意图,如图所示.下列说法正确的是( )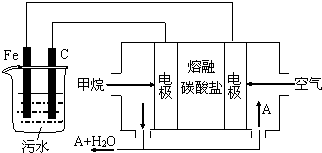

| A. | 该燃料电池是以熔融碳酸盐为电解质,CH4为燃料,空气为氧化剂,则负极的电极反应是CH4+4CO32--8e-═5CO2+2H2O | |
| B. | 实验时若污水中离子浓度较小,导电能力较差,产生气泡速率缓慢,无法使悬浮物形成浮渣,此时,可以向污水中加入适量的稀H2SO4 | |
| C. | 实验过程中,若阴极产生2mol气体,则燃料电池消耗11.2L CH4 | |
| D. | 为了使该电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A参加循环,则A物质是CO32- |
18.下列各离子方程式中,属于水解反应的是( )
| A. | HCO3-+H2O?H3O++CO32- | B. | NH4++H2O?NH3•H2O+OH- | ||
| C. | PO43-+H2O?HPO42-+OH- | D. | H2O+H2O?H3O++OH- |
15.下列除去杂质的方法正确的是物质杂质试剂主要操作( )
| 物质 | 杂质 | 试剂 | 主要操作 | |
| A | Fe2O3 | SiO2 | NaOH | 过滤 |
| B | CO2 | CO | O2 | 点燃 |
| C | FeCl2溶液 | FeCl3 | Cu | 分液 |
| D | CH3CH2OH | H2O | Na | 蒸馏 |
| A. | A | B. | B | C. | C | D. | D |
16.用NA表示阿伏加德罗常数的数值,下列叙述正确的是( )
| A. | 电解精炼铜时,若阳极质量减少32g,则阴极转移的电子的数目为NA(注:粗铜含有Zn、Fe等杂质) | |
| B. | 含0.2mol H2SO4的浓硫酸与足量铜充分反应,生成SO2分子的数目少于0.1NA | |
| C. | 在标况下,22.4L SO3和22.4L C2H4原子个数比为2:3 | |
| D. | 将78g Na2O2与过量CO2反应,CO2转移的电子数为2NA |