题目内容
11.A、B、C、D、E五种短周期元素的原子序数逐渐增大.A是原子半径最小的元素,B可形成多种同素异形体,其中一种的硬度是自然界中最大的.D元素原子的最外层电子数是次外层电子数的3倍.E元素的M层电子数等于A和B的质子数之和.(1)写出元素D在元素周期表中的位置:第二周期ⅥA族.
(2)B、C、D三种元素的最简单氢化物的稳定性由强到弱的顺序是H2O>NH3>CH4(填化学式).
(3)A、B、C、D几种元素之间可以形成多种10电子微粒,写出上述10电子微粒中离子之间发生反应的一个离子方程式:NH3+H2O=NH3•H2O或OH-+NH4+=NH3•H2O.
(4)ED2是一种具有强氧化性的新型消毒剂,一定条件下4mol ED与5mol C2A4恰好完全反应,请写出该反应的化学方程式:4ClO2+5N2H4=5N2+4HCl+8H2O;若反应消耗1mol C2A4,则转移电子的物质的量为4mol.
分析 A、B、C、D、E五种元素均为短周期元素,原子序数逐渐增大;A是原子半径最小的元素,则A为H元素;D元素原子的最外层电子数是次外层电子数的3倍,则D含有2个电子层,最外层含有6个电子,为O元素;B可形成多种同素异形体,其中一种的硬度自然界中最大,该物质为金刚石,则B为C元素;E元素的M层电子数等于A和B的质子数之和,则E为Cl元素;C的原子序数介于C元素和O元素之间,则C为N元素,根据分析可知:A、B、C、D、E分别为H、C、N、O、Cl,据此进行解答.
解答 解:A、B、C、D、E五种元素均为短周期元素,原子序数逐渐增大;A是原子半径最小的元素,则A为H元素;D元素原子的最外层电子数是次外层电子数的3倍,则D含有2个电子层,最外层含有6个电子,为O元素;B可形成多种同素异形体,其中一种的硬度自然界中最大,该物质为金刚石,则B为C元素;E元素的M层电子数等于A和B的质子数之和,则E为Cl元素;C的原子序数介于C元素和O元素之间,则C为N元素,根据分析可知:A、B、C、D、E分别为H、C、N、O、Cl,
(1)D为O元素,原子序数为8,位于周期表中第二周期ⅥA族,
故答案为:第二周期ⅥA族;
(2)非金属性越强,气态氢化物越稳定,非金属性:O>N>C,则对应的气态氢化物的稳定性为:H2O>NH3>CH4,
故答案为:H2O>NH3>CH4;
(3)10个电子的离子可以以氖为中心,氖前面的阴离子和氖后面的阳离子以及阴离子对应的氢化物、氢化物的阴阳离子等,H、C、N、O形成的10电子粒子有:CH4、NH3(NH2-、NH4+)、H2O(H3O+、OH-)、HF等,以上10电子微粒之间反应的其中一个化学方程式为:NH3+H2O=NH3•H2O或OH-+NH4+=NH3•H2O,
故答案为:NH3+H2O=NH3•H2O或OH-+NH4+=NH3•H2O;
(4)E为Cl元素,ED2为ClO2,C2A4为N2H4,一定条件下4mol ClO2与5mol N2H4恰好完全反应,反应的化学方程式为4ClO2+5N2H4=5N2+4HCl+8H2O,
根据方程式可知,每消耗5molN2H4,转移电子的物质的量为20mol,所以若反应消耗1mol N2H4,则转移电子的物质的量为4mol,
故答案为:4ClO2+5N2H4=5N2+4HCl+8H2O;4mol.
点评 本题考查了位置、结构与性质关系的应用,题目难度中等,正确推断各元素名称为解答关键,注意掌握常见化学用语的概念及表示方法,能够用单线桥、双线桥分析氧化还原反应,试题培养了学生灵活应用所学知识解决实际问题的能力.

 字词句段篇系列答案
字词句段篇系列答案①强酸pH=a,加水稀释到10n倍,则pH=a+n
②强碱pH=b,加水稀释到10n倍,则pH=b-n
③弱酸pH=a,加水稀释到10n倍,则pH<a+n(a+n<7)
④弱碱pH=b,加水稀释到10n倍,则pH>b-n(b-n>7)
| A. | ①② | B. | ②③ | C. | ③④ | D. | ②④ |
| A. | CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(2y-x) kJ•mol-1 | |
| B. | CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(2x-y) kJ•mol-1 | |
| C. | CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(4x-y) kJ•mol-1 | |
| D. | CO2(g)+2NaOH(l)═2NaHCO3(l)△H=-(8x-2y) kJ•mol-1 |
| A. | 14C原子的结构示意图: | |
| B. | H2O2的电子式: | |
| C. | NH4C的电子式: | |
| D. | 原子核内有10个中子的氧原子${\;}_{8}^{16}$O |
| A. | 25℃,$\frac{{K}_{W}}{c({H}^{+})}$=0.1mol/L的溶液中:ClO-、Cl-、K+、HSO3- | |
| B. | 无色强酸性溶液中:Na+、Cl-、SO42-、[Cu(NH3)4]2+ | |
| C. | 水电离产生的c(H+)=10-13 mol•L-1的溶液中:Na+、Cl-、NO3-、SO42- | |
| D. | 加入Al能放出H2的溶液中:NH4+,SO42-,Br-,NO3- |
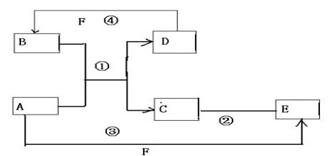
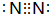 反应?①的化学方程式2NH3+3Cl2=N2+6HCl
反应?①的化学方程式2NH3+3Cl2=N2+6HCl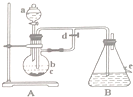 如图所示装置,可用来制取和观察Fe(OH)2在空气中被氧化的颜色变化.实验时必须使用铁屑和6mol/L的硫酸,其他试剂任选.填写下列空白:
如图所示装置,可用来制取和观察Fe(OH)2在空气中被氧化的颜色变化.实验时必须使用铁屑和6mol/L的硫酸,其他试剂任选.填写下列空白: