题目内容
14.某学习小组对课本中“氯化钠能用于制烧碱”的内容产生兴趣,查阅资料得知:2NaCl+2H2O $\frac{\underline{\;通电\;}}{\;}$ 2NaOH+H2↑+Cl2↑.
为验证该反应能制烧碱,同学们用图1装置进行了电解饱和氯化钠溶液的实验,通电一段时间后,关闭电源,从K处倒出溶液作为待测液进行如下探究.
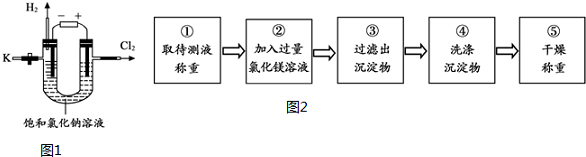
【探究一】检验待测液中含有氢氧化钠检验含有氢氧化钠的方法是取样,滴加无色酚酞溶液,溶液变红色.
【探究二】测定待测液中氢氧化钠的质量分数
查阅资料:Ⅰ.氢氧化镁不溶于水.
Ⅱ.氢氧化钠与氯化镁溶液能发生复分解反应,化学方程式为:2NaOH+MgCl2=Mg(OH)2↓+2NaCl.进行实验:实验步骤如图2所示.
(1)步骤②加入的氯化镁溶液必需过量,其目的是使NaOH完全反应.实验过程中,判断所加氯化镁溶液是否过量的方法是取步骤②上层清液于试管中,滴加氢氧化钠溶液,若有白色沉淀生成,则所加氯化镁溶液过量,反之,则不过量.
(2)实验过程中若缺少步骤④的操作,则测定的待测液中氢氧化钠的质量分数将偏大(填“偏大”、“偏小”或“没影响”).
分析 【探究一】根据氢氧化钠能使酚酞试液变红色分析回答;
【探究二】查阅资料:氢氧化钠与氯化镁的反应生成氢氧化镁和氯化钠;
(1)氯化镁能与氢氧化钠反应,过量氯化镁溶液能将氢氧化钠全部反应掉,根据溶液中是否有过量的镁离子判断所加氯化镁溶液是否过量;
(2)利用沉淀物的质量计算氢氧化钠的质量分数时,若不洗涤沉淀,那么沉淀上会附着一些杂质,从而使沉淀的质量增大,会导致计算出的氢氧化钠质量偏大,使所测定氢氧化钠的质量分数偏大.
解答 解:【探究一】由于氢氧化钠溶液能使酚酞试液变红色,所以检验含有氢氧化钠的方法是:取样,滴加无色酚酞溶液,溶液变红色,
故答案为:取样,滴加无色酚酞溶液,溶液变红色;
【探究二】
查阅资料:
Ⅱ.氢氧化钠与氯化镁溶液能发生复分解反应生成了氢氧化镁沉淀和氯化钠,化学方程式为:2NaOH+MgCl2=Mg(OH)2↓+2NaCl,
故答案为:2NaOH+MgCl2=Mg(OH)2↓+2NaCl;
(1)由于氢氧化钠与氯化镁溶液能发生反应生成了氢氧化镁沉淀和氯化钠,所以,步骤②加入的氯化镁溶液必需过量,其目的是使NaOH完全反应.实验过程中,判断所加氯化镁溶液是否过量的方法是:取步骤②上层清液于试管中,滴加氢氧化钠溶液,若有白色沉淀生成,则所加氯化镁溶液过量,反之,则不过量,
故答案为:使NaOH完全反应;取步骤②上层清液于试管中,滴加氢氧化钠溶液,若有白色沉淀生成,则所加氯化镁溶液过量,反之,则不过量;
(2)利用沉淀物的质量计算氢氧化钠的质量分数,若缺少步骤④的操作,沉淀中因含有其他杂质而质量偏大,所测定氢氧化钠的质量分数将偏大,
故答为:偏大.
点评 本题考查了物质的制备、提纯等实验基本操作,难度不大,注意元素化合物质知识与实验基本操作的灵活运用,本题对学生的分析问题解决问题的能力有一定的要求.

 名校课堂系列答案
名校课堂系列答案①强酸pH=a,加水稀释到10n倍,则pH=a+n
②强碱pH=b,加水稀释到10n倍,则pH=b-n
③弱酸pH=a,加水稀释到10n倍,则pH<a+n(a+n<7)
④弱碱pH=b,加水稀释到10n倍,则pH>b-n(b-n>7)
| A. | ①② | B. | ②③ | C. | ③④ | D. | ②④ |
| A. | CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(2y-x) kJ•mol-1 | |
| B. | CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(2x-y) kJ•mol-1 | |
| C. | CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(4x-y) kJ•mol-1 | |
| D. | CO2(g)+2NaOH(l)═2NaHCO3(l)△H=-(8x-2y) kJ•mol-1 |
| A. | 二氧化硫气体通入过氧化钠:2SO2+2Na2O2═2Na2SO3+O2↑ | |
| B. | 金属铝投入NaOH溶液中:Al+2OH-═AlO${\;}_{2}^{-}$+H2↑ | |
| C. | 硫酸亚铁与酸性高锰酸钾反应:3Fe2++MnO${\;}_{4}^{+}$+4H+=3Fe3++MnO2↓+2H2O | |
| D. | 碳酸氢钠溶液与少量石灰水反应:2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+2H2O |
 铁是目前人类使用量最大的金属,它能形成多种化合物.
铁是目前人类使用量最大的金属,它能形成多种化合物.
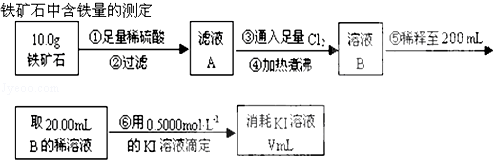
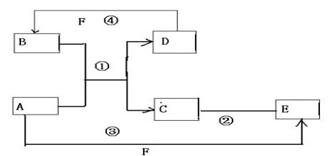
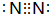 反应?①的化学方程式2NH3+3Cl2=N2+6HCl
反应?①的化学方程式2NH3+3Cl2=N2+6HCl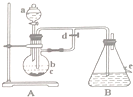 如图所示装置,可用来制取和观察Fe(OH)2在空气中被氧化的颜色变化.实验时必须使用铁屑和6mol/L的硫酸,其他试剂任选.填写下列空白:
如图所示装置,可用来制取和观察Fe(OH)2在空气中被氧化的颜色变化.实验时必须使用铁屑和6mol/L的硫酸,其他试剂任选.填写下列空白: