题目内容
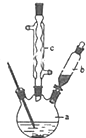
2.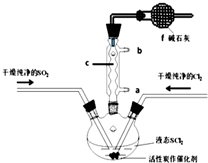 SOCl2是一种液态化合物,沸点为77℃,在农药、制药行业中用途广泛.SOCl2遇水剧烈反应,液面上产生白雾,并带有刺激性气味的气体产生.实验室合成原理:SO2+Cl2+SCl2=2SOCl2,部分装置如图所示,回答以下问题:
SOCl2是一种液态化合物,沸点为77℃,在农药、制药行业中用途广泛.SOCl2遇水剧烈反应,液面上产生白雾,并带有刺激性气味的气体产生.实验室合成原理:SO2+Cl2+SCl2=2SOCl2,部分装置如图所示,回答以下问题:(1)装置f的作用是吸收逸出有毒的Cl2、SO2,防止空气中的水蒸气进入反应装置,防止SOCl2水解.
(2)实验室制Cl2的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(3)SOCl2与水反应的化学方程式为SOCl2+H2O=SO2↑+2HCl↑.蒸干AlCl3溶液不能得到无水AlCl3,但使SOCl2与AlCl3•6H2O混合加热,可得到无水AlCl3,试解释原因:AlCl3溶液易水解,AlCl3•6H2O与SOCl2混合加热,SOCl2与AlCl3•6H2O中的结晶水作用,生成无水AlCl3及SO2和HCl气体,SOCl2吸水,产物SO2和HCl抑制AlCl3水解;
(4)下列四种制备SO2的方案中最佳选择是丁
| 方案 | 甲 | 乙 | 丙 | 丁 |
| 发生装置 | 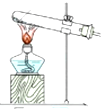 |  | 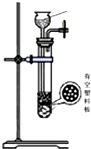 | 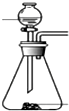 |
| 所选试剂 | NaHSO3固体 | 18.4mol/LH2SO4+Cu | 4mol/LHNO3+Na2SO | 70%H2SO4+K2SO3 |
(6)分离产物后,向获得的SOCl2中加入足量NaOH溶液,振荡、静止得到无色溶液w,检验溶液w中存在的Cl-的方法是取少量无色溶液放入试管中,加入Ba(NO3)2溶液至不再生沉淀为止,静置,取出上层清液,加入AgNO3溶液,有白色沉淀生成,可知无色溶液中含有Cl-.
分析 (1)碱石灰与气体反应;
(2)实验室利用MnO2、4HCl(浓)制备氯气;
(3)SOCl2与水反应的方程式为:SOCl2+H2O=SO2↑+2HCl↑,AlCl3溶液易水解,AlCl3•6H2O与SOCl2混合加热,SOCl2与AlCl3•6H2O中的结晶水作用,生成无水AlCl3及SO2和HCl气体,SOCl2吸水,产物SO2和HCl溶于水呈酸性抑制水解发生;
(4)丁中固体与液体反应制取二氧化硫比较合理,制取气体需要纯净,操作简单;
(5)已知氯化亚砜沸点为77℃,已知SCl2的沸点为50℃,所以采用分馏的方法即可将之分离.消耗氯气为$\frac{0.896L}{22.4L/mol}$=0.04mol,由SO2+Cl2+SCl2═2SOCl2,生成0.08molSOCl2,以此来解答;
(6)先加硝酸钡,且排除干扰离子,再加硝酸银观察是否生成白色沉淀检验氯离子.
解答 解:(1)仪器c是球形冷凝管,f有两个作用一个是防止有毒的氯气与二氧化硫逸出对实验人员的身体健康造成威胁,一个是防止空气中的水蒸气进入烧瓶中使氯化亚砜水解,
故答案为:吸收逸出有毒的Cl2、SO2,防止空气中的水蒸气进入反应装置,防止SOCl2水解;
(2)实验室氯气制备的方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(3)SOCl2与水反应的方程式为:SOCl2+H2O=SO2↑+2HCl↑,AlCl3溶液易水解,AlCl3•6H2O与SOCl2混合加热,SOCl2与AlCl3•6H2O中的结晶水作用,生成无水AlCl3及SO2和HCl气体,SOCl2吸水,产物SO2和HCl溶于水呈酸性抑制水解发生,
故答案为:SOCl2+H2O=SO2↑+2HCl↑;AlCl3溶液易水解,AlCl3•6H2O与SOCl2混合加热,SOCl2与AlCl3•6H2O中的结晶水作用,生成无水AlCl3及SO2和HCl气体,SOCl2吸水,产物SO2和HCl抑制AlCl3水解;
(4)因为甲中加热亚硫酸氢钠确实会产生二氧化硫,但是同时也会生成水,所以向下倾斜试管自然是不行.乙中18.4mol/L的硫酸太浓,其中水分过少硫酸任然以分分子形式存在,无法与铜反应制取二氧化硫.乙中无论是浓硝酸还是稀硝酸都具有很强的氧化性可以轻易的将亚硫酸钠中的正4价的硫氧化为正6价的硫酸根离子而无法得到二氧化硫.丁中反应生成硫酸钾与二氧化硫还有水,丁制取二氧化硫比较合理,
故答案为:丁;
(5)已知氯化亚砜沸点为77℃,已知SCl2的沸点为50℃,所以采用分馏的方法即可将之分离;消耗氯气为$\frac{0.896L}{22.4L/mol}$=0.04mol,由SO2+Cl2+SCl2═2SOCl2,生成0.08molSOCl2,则SOCl2的产率为$\frac{4.76g}{0.08mol×119g/mol}$×100%=50%,
故答案为:蒸馏;50%;
(6)向获得的SOCl2中加入足量NaOH溶液,振荡、静止得到无色溶液w,含亚硫酸根离子和氯离子,检验溶液w中存在的Cl-的方法是取少量无色溶液放入试管中,加入Ba(NO3)2溶液至不再生沉淀为止,静置.取出上层清液,加入AgNO3溶液,有白色沉淀生成,可知无色溶液中含有Cl-,
故答案为:取少量无色溶液放入试管中,加入Ba(NO3)2溶液至不再生沉淀为止,静置,取出上层清液,加入AgNO3溶液,有白色沉淀生成,可知无色溶液中含有Cl-.
点评 本题考查物质的制备实验,为高考常见题型,把握制备实验及发生的反应为解答的关键,侧重于学生的分析能力和实验能力的考查,注意常见气体的制备原理及应用,题目难度中等.

| A. | 1.8×10-13 mol•L-1 | B. | 7.3×10-13 mol•L-1 | ||
| C. | 2.3 mol•L-1 | D. | 3.7 mol•L-1 |
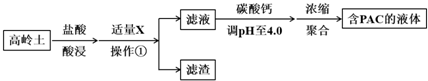
(1)盐酸酸浸所涉及反应的离子方程式是6H++Al2O3═2Al3++3H2O、6H++Fe2O3═2Fe3++3H2O.
(2)已知:
生成氢氧化物沉淀的pH
| Al(OH)3 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 1.5 |
| 完全沉淀时 | 4.7 | 2.8 |
根据表中数据解释加入X的主要目的:调节溶液pH至Fe3+完全沉淀,滤渣中主要含有物质的化学式是Fe(OH)3、SiO2.
(3)已知:生成液体PAC的反应为2Al3++m(6-n) Cl-+mn H2O?[Al2(OH)nCl6-n]m+mn H+.
用碳酸钙调节溶液的pH时,要严控pH的大小,pH偏小或偏大液体PAC的产率都会降低.请解释pH偏小液体PAC产率降低的原因:pH偏小时,抑制平衡2Al3++m(6-n) Cl-+mn H2O?[Al2(OH)nCl6-n]m+mn H+ 正向移动生成PAC.
(4)浓缩聚合得到含PAC的液体中铝的各种形态主要包括:
Ala--Al3+单体形态铝
Alb--[Al2(OH)nCl6-n]m聚合形态铝
Alc--Al(OH)3胶体形态
图1为Al各形态百分数随温度变化的曲线;图2为含PAC的液体中铝的总浓度AlT随温度变化的曲线.

①50-90℃之间制备的液体PAC中,聚合形态铝含量最多.
②当T>80℃时,AlT明显降低的原因是温度升高,导致液体PAC向Al(OH)3沉淀转化.
(1)如用图I装置制取氨气,锥形瓶中可选择的试剂是氢氧化钠固体(或浓氨水与碱石灰或浓氨水与生石灰)等.
(2)制备氨基甲酸铵的装置如下图Ⅱ所示,把NH3和CO2通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵的小晶体悬浮在CCl4中.当悬浮物较多时,停止制备.
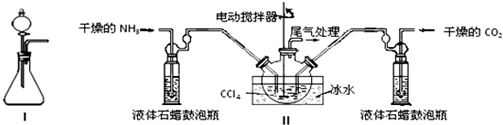
注:CCl4与液体石蜡均为惰性介质.
①%2图I中滴加液体的仪器名称是分液漏斗,液体石蜡鼓泡瓶的作用是通过观察气泡,调节NH3与CO2通入比例(或通过观察气泡,控制NH3与CO2的反应速率),发生器用冰水冷却的原因是降低温度,提高反应物转化率(或降低温度,防止因反应放热造成产物分解).
②从反应后的混合物中分离出产品的实验方法是过滤(填写操作名称),为了得到干燥产品,应采取的方法是b(填写选项序号).
a.常压加热烘干 b.减压40℃以下烘干 c.高压加热烘干
(3)制得的氨基甲酸铵可能含有碳酸氢铵、碳酸铵中的一种或两种.
①设计方案,进行成分探究,请填写表中空格.
限选试剂:蒸馏水、稀HNO3、BaCl2溶液、Ba(OH)2溶液、AgNO3溶液、稀盐酸.
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量固体样品于试管中,加入蒸馏水至固体溶解. | 得到无色溶液 |
| 步骤2:向试管中加入过量的BaCl2溶液,静置. | 溶液变浑浊,则证明固体中含有(NH4)2CO3. |
| 步骤3:取步骤2的上层清液于试管中加入少量的Ba(OH)2溶液. | 溶液不变浑浊,则证明固体中不含有NH4HCO3. |
| H2C2O4 | 无色晶体 | K1=5.9×10-2,K2=6.4×10-5,能溶于水和乙醇 |
| Na2C2O4 | 白色晶体 | 微溶于水,pH=7.2,不溶于乙醇 |
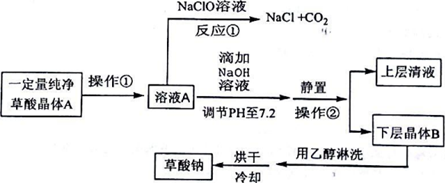
请回答下列问题:
(1)写出反应①的化学方程式H2C2O4+NaC1O=NaC1+2CO2↑+H2O.表明草酸具有还原性.
(2)向溶液A中加入NaOH溶液,开始滴加速度要尽量快些.其目的是利用中和反应放热,升温促进反应(或增大反应速率).该反应达到终点时的化学方程式为H2C2O4+2NaOH=Na2C2O4↓+2H2O.
(3)操作②的名称是过滤.用乙醇淋洗晶体B的目的是除去晶体表面水分减少损失
(4)用0.01000mol/L的高锰酸钾溶液滴定25.00mL某浓度的草酸钠溶液时.需要加入适量的稀硫酸,所发生反应为:5C2O42-+2MnO4-+16H+═2Mn2++10CO2↑+8H2O,若硫酸加入太多,结果会草酸根会生成草酸氢根和草酸,使溶液中草酸根离子浓度降低,减慢反应速率:操作中需用酸式演定管(填“酸式”或“碱式”),当达到反应终点时的现象是溶液呈现浅紫色且30s内不褪色;测得此时消耗上述高锰酸钾溶液20.00mL,则该草酸钠溶液浓度为0.0200mol/L.
| A. | 1mol/L Na2CO3溶液中的Na+ 数目为2NA | |
| B. | 标准状况下,11.2L CCl4所含分子数为0.5NA | |
| C. | 各5.6 g铁分别与足量的盐酸、氯气反应,电子转移总数均为0.2NA | |
| D. | 1 mol Na与足量O2反应生成Na2O或Na2O2均失去NA电子 |
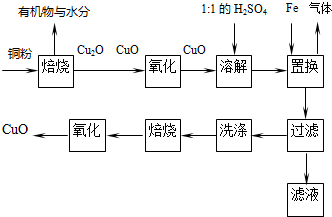
 苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要前驱之一.下面是它的一种实验室合成路线:
苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要前驱之一.下面是它的一种实验室合成路线: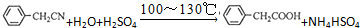

 某学生为测定未知浓度的硫酸溶液,进行如下实验:用1.00mL待测硫酸溶液配制100mL稀H2SO4溶液;以0.14mol•L-1的NaOH溶液滴定上述稀H2SO4 25.00mL,滴定终止时消耗NaOH溶液15.00mL.
某学生为测定未知浓度的硫酸溶液,进行如下实验:用1.00mL待测硫酸溶液配制100mL稀H2SO4溶液;以0.14mol•L-1的NaOH溶液滴定上述稀H2SO4 25.00mL,滴定终止时消耗NaOH溶液15.00mL.