题目内容
19.X、Y、Z、W是原子序数依次增大的短周期元素,其中X原子与Y原子可形成具有10个电子的M分子,Y元素最高价氧化物对应的水化物与M反应会生成一种离子化合物,Z元素原子的最外层电子数为2,W元素的单质可用于自来水的消毒杀菌.下列说法正确的是( )| A. | 非金属性:Y>X>W | |
| B. | Z与W形成的化合物中存在共价键 | |
| C. | 一定条件下Z3Y2与水反应可生成M | |
| D. | 工业上用W单质与澄清石灰水反应制取漂白粉 |
分析 X、Y、Z、W是原子序数依次增大的短周期元素,其中X原子与Y原子可形成具有10个电子的M分子,Y元素最高价氧化物对应的水化物与M反应会生成一种离子化合物,则X为H,Y为N,M为氨气,Z元素原子的最外层电子数为2,Z为Mg元素,W元素的单质可用于自来水的消毒杀菌,W为Cl,以此来解答.
解答 解:由上述分析可知,X为H,Y为N,Z为Mg,W为Cl,
A.电子层越多,原子半径越大,同周期从左向右原子半径减小,则非金属性:W>Y>X,故A错误;
B.Z与W形成的化合物为氯化镁,只含离子键,故B错误;
C.Mg3N2与水反应生成氢氧化镁、氨气,M为氨气,故C正确;
D.氯气与石灰乳反应制取漂白粉,因石灰水的浓度小,故D错误;
故选C.
点评 本题考查原子结构与元素周期律,为高频考点,把握元素化合物知识、原子结构来推断元素为解答的关键,侧重分析与应用能力的考查,注意水解反应及离子化合物的应用,题目难度不大.

练习册系列答案
 习题精选系列答案
习题精选系列答案
相关题目
11.分子式为C5H8O2,能使溴的CC14溶液褪色且分子中含有一个甲基的羧酸类物质共有(不含立体异构)( )
| A. | 6种 | B. | 5种 | C. | 4种 | D. | 3种 |
10.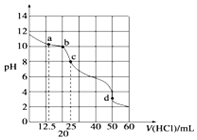 在常温下,0.10mol•L-1Na2CO3溶液25mL 用0.10mol•L-1盐酸滴定,其滴定曲线如图.对滴定过程中所得溶液中相关离子浓度间的关系,下列有关说法正确的是( )
在常温下,0.10mol•L-1Na2CO3溶液25mL 用0.10mol•L-1盐酸滴定,其滴定曲线如图.对滴定过程中所得溶液中相关离子浓度间的关系,下列有关说法正确的是( )
 在常温下,0.10mol•L-1Na2CO3溶液25mL 用0.10mol•L-1盐酸滴定,其滴定曲线如图.对滴定过程中所得溶液中相关离子浓度间的关系,下列有关说法正确的是( )
在常温下,0.10mol•L-1Na2CO3溶液25mL 用0.10mol•L-1盐酸滴定,其滴定曲线如图.对滴定过程中所得溶液中相关离子浓度间的关系,下列有关说法正确的是( )| A. | a点:c(CO32-)=c(HCO-3)>c(OH-) | B. | b点:5c(Cl-)>4c(HCO-3)+4c(CO2-3) | ||
| C. | c点:c(OH-)=c(H+)+c(HCO-3)+2c(H2CO3) | D. | d点:c(H+)=c(CO2-3)+c(HCO-3)+c(OH-) |
7.某些建筑材料含有放射性元素氡(22286Rn).研究表明氡的α射线会致癌,WHO认定的19种致癌因素中,氡为其中之一,仅次于吸烟.该原子中中子数和质子数之差是( )
| A. | 136 | B. | 50 | C. | 86 | D. | 222 |
14.下列有关电化学的说法正确的是( )
| A. | 锌锰干电池工作一段时间后碳棒变细 | |
| B. | 在海轮外壳上镶入锌块可减缓船体的腐蚀,是采用了牺牲阳极的阴极保护法 | |
| C. | 铜锌原电池工作时,电子沿外电路从铜电极流向锌电极 | |
| D. | 电解MgCl2饱和溶液,可制得金属镁 |
11.肼(N2H4)是一种燃料,已知:
①N2(g)+2O2(g)=2NO2(g)△H=+67.7kJ/mol
②N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534kJ/mol
③H2O(g)=H2O(l )△H=-44kJ/mol
下列说法正确的是( )
①N2(g)+2O2(g)=2NO2(g)△H=+67.7kJ/mol
②N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534kJ/mol
③H2O(g)=H2O(l )△H=-44kJ/mol
下列说法正确的是( )
| A. | 反应②中反应物所具有的总能量大于生成物所具有的总能量 | |
| B. | 2N2H4(g)+2NO2(g)=3N2(g)+4H2O(l)△H=-1135.7 kJ/mol | |
| C. | 铂作电极,KOH溶液作电解质溶液,由反应②设计的燃料电池,当电路中转移0.16mole-,生成N211.2g | |
| D. | 铂作电极,Na2SO4作电解质溶液,由反应②设计的燃料电池,工作一段时间后恢复至原温度,Na2SO4溶液的pH不变 |
 某小组在研究前18号元素时发现:依据不同的标准和规律,元素周期表有不同的排列形式.如果将它们按原子序数递增的顺序排列,可形成图所示的“蜗牛”形状,图中每个“.”代表一种元素,其中P点代表氢元素.
某小组在研究前18号元素时发现:依据不同的标准和规律,元素周期表有不同的排列形式.如果将它们按原子序数递增的顺序排列,可形成图所示的“蜗牛”形状,图中每个“.”代表一种元素,其中P点代表氢元素.