题目内容
12.在某一容积为2L的密闭容器内,加入0.8mol的H2和0.6mol的I2,在一定的条件下发生如下反应:H2(g)+I2(g)?2HI(g);△H<0.反应中各物质的浓度随时间变化情况如图1: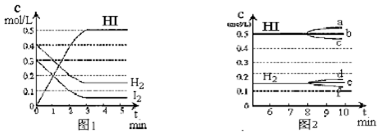
(1)计算该反应的化学平衡常数k33.3,平衡时n(HI)=1mol;
(2)根据图1数据,反应开始至达到平衡时,反应速率 v(HI)为0.17mol/(L•min);
(3)反应达到平衡后,第8分钟时:①若升高温度,化学平衡常数K减小(填写增大、减小或不变)HI浓度的变化正确的是c;(用图2中a~c的编号回答)
②若加入I2(g),H2浓度的变化正确的是f.(用图2中d~f的编号回答)
分析 (1)根据平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积进行计算,在某一容积为2L的密闭容器内达到平衡状态HI物质的量n=cV;
(2)根据v=$\frac{△c}{△t}$计算平均速率v(HI);
(3)①根据化学平衡常数K只与温度有关,温度改变,若平衡正向移动,化学平衡常数K增大,生成物浓度增大,反之,若平衡逆向移动,化学平衡常数K减少,生成物浓度减少;
②若加入I2,平衡正向移动,H2浓度减少.
解答 解:(1)图象中数据计算物质的平衡浓度为:
H2(g)+I2(g)?2HI(g)
起始量(mol/L) 0.4 0.3 0
变化量(mol/L) 0.25 0.25 0.5
平衡量(mol/L) 0.15 0.05 0.5
平衡常数K=$\frac{{c}^{2}(HI)}{c({H}_{2})c({I}_{2})}$=$\frac{0.{5}^{2}}{0.15×0.05}$=33.3,
平衡状态下n(HI)=0.5mol/L×2L=1mol,
故答案为:33.3;1mol;
(2)平均速率v(HI)=$\frac{0.5mol/L}{3min}$=0.17mol•L-1•min-1,故答案为:0.17mol;
(3)①该反应放热,升高温度,平衡逆向移动,化学平衡常数K减少,生成物浓度减少,故答案为:减少;c;
②若加入I2,平衡正向移动,H2浓度减少,故答案为:f.
点评 本题主要考查了平衡常数、化学平衡移动以及化学反应速率的计算,题目难度不大,需要注意的是:化学平衡常数K只与温度有关,温度改变,若平衡正向移动,化学平衡常数K增大,反之则减少.

| A. | 进行萃取操作时,应选择有机萃取剂,且萃取剂的密度要比水大 | |
| B. | 进行蒸馏操作时,应使温度计的水银球靠近蒸馏烧瓶的瓶口处 | |
| C. | 进行分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 进行蒸发操作时,应将蒸发皿中溶液蒸干后,再停止加热 |
| A. | 原子半径大小顺序:W>Z>Y>X | |
| B. | X、Y、W都能与氧元素形成两种氧化物 | |
| C. | W的最高价氧化物的水化物的酸性比Z的弱 | |
| D. | W分别与X、Y形成的化合物中化学键类型相同 |
(1)某温度时,Kap=1.0×10-12,若在该温度时,某溶液的c(H+)=1.0×10-7mol/L,则该溶液呈碱性.
(2)常温下,浓度均为0.1mol•L-1的下列六种溶液的pH如表:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.0 |
②根据表中数据判断,浓度均为0.01mol•L-1的下列五种物质的溶液中,酸性最强的是D;将各溶液分别稀释100倍,pH变化最小的是A(填编号).
A.HCN B.HClO C.C6H5OH D.CH3COOH
③据表数据,请计算0.1mol/L的NaCN溶液中水电离出的氢氧根离子浓度1.0×10-3mol/L
④要增大氯水中HClO的浓度,可向氯水中加入少量的碳酸钠溶液,请用平衡移动原理解释其原因因为CO32-会结合反应Cl2+H2O?H++Cl-+HClO生成的H+,使平衡向右移动(写离子方程式并用必要的文字说明)
(3)在0.1mol/L的NaClO溶液中,写出离子浓度的大小关系c(Na+)>c(ClO-)>c(OH-)>c(H+).
| A. | Na2SO3溶液使酸性高锰酸钾溶液褪色:5SO32-+6H++2MnO4-=5SO42-+2Mn2++3H2O | |
| B. | 铵明矾溶液中加入过量的氢氧化钡溶液:Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O | |
| C. | 向碳酸氢钙溶液中加入过量氢氧化钠溶液:Ca 2++2HCO 3 -+2OH -=BaCO 3↓+CO 3 2- 十2H 2 O | |
| D. | 弱酸尼泊金酸( 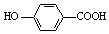 )与碳酸氢钠溶液反应: )与碳酸氢钠溶液反应: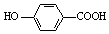 +HCO3-→ +HCO3-→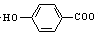 -+CO2↑+H2O -+CO2↑+H2O |
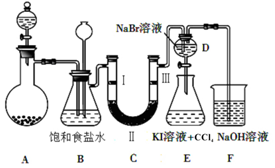
(1)制备氯气选用的药品为固体二氧化锰和浓盐酸,图示装置还缺少的一种仪器为酒精灯.装置B中饱和食盐水的作用是除去Cl2中的HCl气体;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象:B中长颈漏斗中液面上升,形成水柱.
(2)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入d(填字母).
| a | b | c | d | |
| Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(4)装置F中用足量的NaOH溶液吸收余氯,试写出相应的离子方程式:2OH-+Cl2=Cl-+ClO-+H2O.

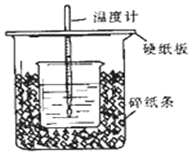 ①用50mL0.50mol/L盐酸与50mL一定浓度的NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.该装置有两处明显的错误,其中一处是缺少一种玻璃仪器,该仪器的名称环形玻璃搅拌棒,另一处错误是小烧杯口和大烧杯口没有平齐.
①用50mL0.50mol/L盐酸与50mL一定浓度的NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.该装置有两处明显的错误,其中一处是缺少一种玻璃仪器,该仪器的名称环形玻璃搅拌棒,另一处错误是小烧杯口和大烧杯口没有平齐.