��Ŀ����
17��ϣ����ѧ������ʿ������������м�����Arsenikon���ƻƣ����ۻƣ�As4S4���ʹƻƣ�As2S3������ȡ�����Ҫ����ԭ�ϣ���������Ȼ���й�������1���ڹ��ز��ز��鷨�У�Na3AsO4��Һ��Zn��Ӧ����AsH3���÷�Ӧ��Na3AsO4a������ĸ����
a���������� b������ԭ�� c������������������ԭ��
��2��As2S3��SnCl2�������з�Ӧת��ΪAs4S4��SnCl4���ų�H2S���壬��As2S3��SnCl2ǡ����ȫ��Ӧ����ԭ���뻹ԭ��������ʵ���֮��Ϊ2��1��
��3��As2S3������Ũ���ᷢ����Ӧ��������48g Sʱ������NO2�����Ϊ112L����״���£���Ԫ��As���������еĻ��ϼ�Ϊ+5����Ӧ�����Һ�в��������������÷�Ӧ�Ļ�ѧ����ʽΪ��As2S3+10HNO3=2H3AsO4+3S+10NO2��+2H2O��
��4���ۻ��ڿ����м�����300��ʱ�������������������֮һΪ�綾����˪��As2O3������һ��������ΪSO2���ѧʽ��������˫��ˮ��As2O3����ΪH3AsO4����ȥ��д���÷�Ӧ�Ļ�ѧ����ʽ��2H2O2+H2O+As2O3=2H3AsO4��
���� ��1��Na3AsO4��Һ��Zn��Ӧ����AsH3��AsԪ�ػ��ϼ����+5�۱仯Ϊ-3�ۣ����ϼ۽�������������п����ԭ����
��2�����ݷ�Ӧ�����������������Ӧ��������������ԭ��Ӧ��Ӧ�е�ʧ�����غ���������ȫ��Ӧ�Ļ�ԭ���뻹ԭ�������ʵ���֮������𣬻�ԭ������Ԫ�ػ��ϼ۽���������������ԭ���ɣ�
��3��As2S3������Ũ���ᷢ����Ӧ��������48g S�����ʵ���=$\frac{48g}{32g/mol}$=1.5mol����Ӧ��As2S3�����ʵ���Ϊ0.5mol�����ɱ�״����NO2�����Ϊ112L�����ʵ���Ϊ$\frac{112L}{22.4L/mol}$=5mol��SԪ�ػ��ϼ���-2�����ߵ�0�ۣ�0.5molAs2S3��Ӧ����ת��0.5mol��[0-��-2��]��3=3mol��HNO3�������������ɶ�������5mol������ת��Ϊ5mol����5-4��=5mol������ݵ����غ㣬��Asʧ����Ԫ�ػ��ϼ۱仯Ϊx��3+0.5mol��2��x-3��=5mol��x=5�����ɲ���ΪH3AsO4��1molAs2S3+
��10molHNO3����������ԭ��Ӧ�����ԭ���غ���ƽ��д��ѧ����ʽ��
��4���ۻ��ڿ����м�����300��ʱ�� �������������֮һһ��������Ϊ�綾����˪��As2O3��������ԭ���غ��֪��һ��������Ϊ������������������Ԫ�ػ��ϼ�-1�۱仯Ϊ-2�ۣ�AsԪ�ػ��ϼ�+3�۱仯Ϊ+5�ۣ���ϵ����غ��ԭ���غ�д���÷�Ӧ�Ļ�ѧ����ʽ��
��� �⣺��1��Na3AsO4��Һ��Zn��Ӧ����AsH3��AsԪ�ػ��ϼ����+5�۱仯Ϊ-3�ۣ����ϼ۽���Na3AsO4����������п����ԭ����
�ʴ�Ϊ��a��
��2��As2S3��SnCl2�������з�Ӧת��ΪAs4S4��SnCl4���ų�H2S���壬��ӦΪ2As2S3+2SnCl2+4HCl=As4S4+2SnCl4+2H2S��
���ݵ��ӵ�ʧ�غ�֪2molAs2S3������������ԭ�õ�4mol���ӣ�����1molAs4S4����2molSnCl2����ԭ��ʧȥ4mol���ӵõ���������2molSnCl4����ԭ���뻹ԭ��������ʵ���֮��Ϊ2��1��
�ʴ�Ϊ��2��1��
��3��As2S3������Ũ���ᷢ����Ӧ��������48g S�����ʵ���=$\frac{48g}{32g/mol}$=1.5mol����Ӧ��As2S3�����ʵ���Ϊ0.5mol�����ɱ�״����NO2�����Ϊ112L�����ʵ���Ϊ$\frac{112L}{22.4L/mol}$=5mol��SԪ�ػ��ϼ���-2�����ߵ�0�ۣ�0.5molAs2S3��Ӧ����ת��0.5mol��[0-��-2��]��3=3mol��HNO3�������������ɶ�������5mol������ת��Ϊ5mol����5-4��=5mol������ݵ����غ㣬��Asʧ����Ԫ�ػ��ϼ۱仯Ϊx��3+0.5mol��2��x-3��=5mol��x=5�����ɲ���ΪH3AsO4��1molAs2S3��10molHNO3����������ԭ��Ӧ����Ӧ�Ļ�ѧ����ʽΪ��As2S3+10HNO3=2H3AsO4+3S+10NO2��+2H2O��AsԪ�ػ��ϼ���+3�����ߵ�+5�ۣ�SԪ�ػ��ϼ���-2�����ߵ�0�ۣ�������2mol H3AsO4��ת�Ƶ���Ϊ2��2mol+3��2mol=10mol��
�ʴ�Ϊ��+5��As2S3+10HNO3=2H3AsO4+3S+10NO2��+2H2O��
��4���ۻ��ڿ����м�����300��ʱ�� �������������֮һһ��������Ϊ�綾����˪��As2O3��������ԭ���غ��֪��ӦΪ��As4S4+7O2$\frac{\underline{\;300��\;}}{\;}$2As2O3+4SO2����һ��������Ϊ��������˫��ˮ��As2O3����ΪH3AsO4����ȥ��������ԭ��Ӧ�й�����������Ԫ�ػ��ϼ�-1�۱仯Ϊ-2�ۣ�AsԪ�ػ��ϼ�+3�۱仯Ϊ+5�ۣ���ϵ����غ��ԭ���غ�д���÷�Ӧ�Ļ�ѧ����ʽ��2H2O2+H2O+As2O3=2H3AsO4��
�ʴ�Ϊ��SO2��2H2O2+H2O+As2O3=2H3AsO4��
���� ���⿼������Ϣ�������������ʵ�Ӧ�ã���Ҫ��������ԭ��Ӧ����ת�ơ������غ㡢��ѧ����ʽ��д�������жϣ�ע��������ԭ��Ӧ����͵���ת���غ��Ӧ�ã���Ŀ�Ѷ��еȣ�

 ��50mL0.50mol/L������50mL 0.55mol/L NaOH��Һ������ͼ��ʾ��װ���н����кͷ�Ӧ���ⶨǿ����ǿ�Ӧ�ķ�Ӧ�ȣ�
��50mL0.50mol/L������50mL 0.55mol/L NaOH��Һ������ͼ��ʾ��װ���н����кͷ�Ӧ���ⶨǿ����ǿ�Ӧ�ķ�Ӧ�ȣ�| ��ʼ�¶�t1/�� | ��ֹ�¶� t2/�� | �¶Ȳ� ��t2-t1��/�� | |||
| HCl | NaOH | ƽ��ֵ | |||
| 1 | 25.5 | 25.0 | 25.25 | 28.5 | 3.25 |
| 2 | 24.5 | 24.5 | 24.50 | 27.5 | 3.00 |
| 3 | 25.0 | 24.5 | 24.75 | 26.5 | 1.75 |
��2��װ���д�С�ձ�֮����������ĭ���ϵ�Ŀ���Ǽ���ʵ������е�������ʧ��
��3��ijͬѧʵ���¼�����������ʾ�����м�¼����ֹ�¶���ָ��ȫ��Ӧ������Һ������¶ȣ�
��4�������ʵ�鷢���кͷ�Ӧʱ�ų�������Ϊ1.31kJ���кͺ����ɵ���Һ�ı�����c=4.18J/��g•�棩��
��5�������50mL 0.55mol/L�İ�ˮ��NH3•H2O������NaOH��Һ��������ʵ�飬ͨ����õķ�Ӧ�ȼ����к��ȣ����к��ȡ�H��ƫ����ԭ����һˮ�ϰ�Ϊ������ʣ���Ӧ�����е�����Ҫ�����������ʷų�������ƫ�٣�
| A�� | ���� | B�� | ���� | C�� | ���� | D�� | ���� |
| ѡ�� | W | X | Y | Z | 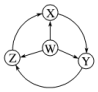 |
| A | Cl2 | FeCl2 | FeCl3 | HClx|k��Com] | |
| B | Na | Na2O2 | NaOH | NaCl | |
| C | NH3 | NO2 | HNO3 | NO | |
| D | Al | AlCl3 | NaAlO2 | Al2��SO4��3 |
| A�� | A | B�� | B | C�� | C | D�� | D |
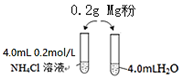 ijУ��ѧ����ѧϰС�鷢�ֽ�þ�۰�ͼͶ�봿ˮ���������ԣ���Ͷ���Ȼ����Һ�У���������������Ӧ�������������ݣ�������ù��̲����������壬����һ�������д̼�����ζ��
ijУ��ѧ����ѧϰС�鷢�ֽ�þ�۰�ͼͶ�봿ˮ���������ԣ���Ͷ���Ȼ����Һ�У���������������Ӧ�������������ݣ�������ù��̲����������壬����һ�������д̼�����ζ����1��ʵ�鿪ʼʱ��У����pH�������ⶨ��ˮ��pH�����ִ�ˮ��pH������7.30���ң���ԭ���������Ϊ���µ���25��ʱ��KwС��1.0��10-14����ˮ��pH�Դ���7
��2������Ƽ�ʵ�鷽����������ʵ�����д̼�����ζ�����壺��ʪ��ĺ�ɫʯ����ֽ�����Թܿڿ��Ƿ������������������а������ɣ�����û�а������ɣ�������պ��Ũ����IJ����������Թܿڣ����Ƿ��а������ɣ�����а������ɣ����а���������û�а�����
��3��ʵ����0.2mol/L�Ȼ����Һ��pHΪ5.90���������ӷ���ʽ����ԭ��NH4++H2O?NH3•H2O+H+
��4����С��ͬѧΪ̽��þ���Ȼ����Һ��Ӧ��ԭ�����������ʵ�鷽����
| ��� | ʵ���Լ� | ʵ������ | |
| ʵ��1-1 | 0.20gþ�� | 3.0mL 0.2mol/LNH4Cl��Һ | ��Ӧ���ԣ������ݲ��� |
| ʵ��1-2 | 0.20gþ�� | 3.0mL���� | ��Ӧ�����ԣ�����û�����ݲ��� |
A��1mol•L-1 B��pH=1.0 C��0.2mol•L-1 D��pH=5.90
��ͨ��ʵ��Աȣ�˵��NH4Clˮ�������H+�Է�ӦӰ��С��NH4+�Է�ӦӰ�죨�С�ڡ��������ڡ����ڡ�����
��5����С��ͬѧ����̽��þ�����Ȼ����Һ��Ӧ���ҵ�Ӱ�����أ�
| ʵ����� | ʵ���Լ� | |
| ʵ��2-1 | 0.20gþ�� | 3.0 mL 0.2mol/LNaCl��Һ |
| ʵ��2-2 | 0.20gþ�� | 3.0 mL0.2mol/LNaNO3��Һ |
| ʵ��3-1 | 0.20gþ�� | 3.0mL0.2mol/L NH4NO3��Һ |
| ʵ��3-2 | 0.20gþ�� | 3.0mL0.2mol/L KNO3��Һ |
��ʵ��3-1��ʵ��3-2�Ľ���˵��NH4+�Է�Ӧ����Ӱ��ܴ�����֧�Թ���ʵ������IJ�֮ͬ����NH4NO3��Һ�����Թܣ���KNO3��Һ�����Թܣ��ֱ���Mg�۷�Ӧ�����Թܷ�Ӧ���ң��д����������ɣ����Թܷ�Ӧ���٣�û����������
��6��д��þ���Ȼ����Һ��Ӧ����Mg2+�����ӷ���ʽMg+2 NH4+=Mg2++2NH3��+H2����

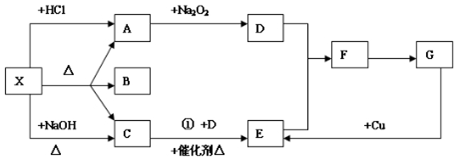
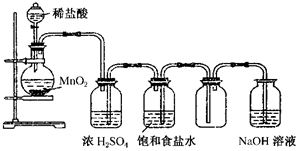 ��ͼ��ʾ��ijѧ����Ƶ�ʵ�����Ʊ�����Cl2�����ն���Cl2��ʵ��װ��ͼ������ͼ�е�װ�ú��й��Լ��ش��������⣮
��ͼ��ʾ��ijѧ����Ƶ�ʵ�����Ʊ�����Cl2�����ն���Cl2��ʵ��װ��ͼ������ͼ�е�װ�ú��й��Լ��ش��������⣮