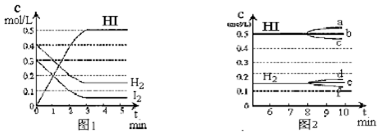
题目内容
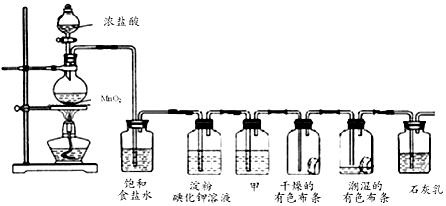
2.如图是实验室制备氯气并进行一系列相关实验的装置(夹持仪器已略).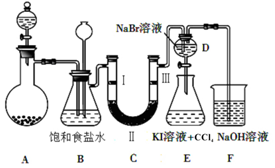
(1)制备氯气选用的药品为固体二氧化锰和浓盐酸,图示装置还缺少的一种仪器为酒精灯.装置B中饱和食盐水的作用是除去Cl2中的HCl气体;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象:B中长颈漏斗中液面上升,形成水柱.
(2)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入d(填字母).
| a | b | c | d | |
| Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(4)装置F中用足量的NaOH溶液吸收余氯,试写出相应的离子方程式:2OH-+Cl2=Cl-+ClO-+H2O.
分析 (1)二氧化锰与浓盐酸在加热条件下反应生成氯化锰、氯气和水;浓盐酸易挥发,制备的氯气中含有氯化氢,氯化氢在饱和食盐水中溶解度较大,氯气在饱和食盐水中溶解度不大;B为安全瓶,监测实验进行时C中是否发生堵塞,发生堵塞时B中的压强增大;
(2)验证氯气是否具有漂白性,要验证干燥氯气无漂白性,湿润的有色布条中,氯气和水反应生成次氯酸具有漂白性;
(3)当向D中缓缓通入少量氯气时,氯气和溴化钠反应生成溴单质,可以看到无色溶液逐渐变为黄色;说明氯气氧化性强于溴单质;打开活塞,将装置D中少量溶液加入装置E中,生成的溴单质和碘化钾反应生成碘单质,碘单质溶解于四氯化碳中,振荡分层,四氯化碳层在下层;
(4)氯气与氢氧化钠反应生成氯化钠和次氯酸钠和水.
解答 解:(1)二氧化锰与浓盐酸在加热条件下反应生成氯化锰、氯气和水,所以缺少的仪器:酒精灯;
制备的氯气中含有氯化氢,氯化氢在饱和食盐水中溶解度较大,氯气在饱和食盐水中溶解度不大,所以可以用B中饱和食盐水吸收氯气中的氯化氢;
监测实验进行时C中是否发生堵塞,发生堵塞时B中的,压强增大,气体将溶液压入长颈漏斗B中,形成水柱;
故答案为:酒精灯; 除去Cl2中的HCl 气体; B中长颈漏斗中液面上升,形成水柱;
(2)装置C的实验目的是验证氯气是否具有漂白性,验证氯气是否具有漂白性,要验证干燥氯气无漂白性,湿润的有色布条中,氯气和水反应生成次氯酸具有漂白性,选项中ab的Ⅱ中都是干燥剂,再通入湿润的有色布条不能验证氯气的漂白性;c中II为固体干燥剂,不能为浓硫酸,所以C中I、II、III依次放入湿润的有色布条、无水氯化钙、干燥的有色布条,所以选d,
故答案为:d;
(3)D中是溴化钠,当向D中缓缓通入少量氯气时,氯气和溴化钠反应生成溴单质,可以看到无色溶液逐渐变为黄,所以现象为:溶液从无色变化为黄色:氧化还原反应中氧化剂的氧化性大于氧化产物,说明氯气的氧化性强于溴;打开活塞,将装置D中含溴单质的少量溶液加入焓碘化钾和四氯化碳的装置E中,溴单质和碘化钾反应生成碘单质,碘单质溶于四氯化碳呈紫红色,振荡.观察到的现象是:E中溶液分为两层,下层(四氯化碳层)为紫红色;
故答案为:黄;E中溶液分为两层,下层(苯层)为紫红色;
(4)氯气与氢氧化钠反应生成氯化钠和次氯酸钠和水:2OH-+Cl2=Cl-+ClO-+H2O;
故答案为:2OH-+Cl2=Cl-+ClO-+H2O.
点评 本题考查了氯气实验室制取、氯气化学性质、实验设计、实验装置的理解评价、化学方程式的书写等,是对所学知识的综合运用,注意基础知识的掌握,本题难度中等.

 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案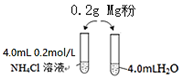 某校化学课外学习小组发现将镁粉按图投入纯水中现象不明显,而投入氯化铵溶液中,两者立即发生反应,产生大量气泡.经检验该过程产生两种气体,其中一种气体有刺激性气味.
某校化学课外学习小组发现将镁粉按图投入纯水中现象不明显,而投入氯化铵溶液中,两者立即发生反应,产生大量气泡.经检验该过程产生两种气体,其中一种气体有刺激性气味.(1)实验开始时用校准过的pH传感器测定纯水的pH,发现纯水的pH总是在7.30左右,其原因可能是因为气温低于25℃时,Kw小于1.0×10-14,纯水的pH略大于7
(2)请设计简单的实验方案检验上述实验中有刺激性气味的气体:将湿润的红色石蕊试纸放在试管口看是否变蓝,如果变蓝,则有氨气生成,否则没有氨气生成(或者用蘸有浓盐酸的玻璃棒放在试管口,看是否有白烟生成,如果有白烟生成,则有氨气,否则没有氨气)
(3)实验中0.2mol/L氯化铵溶液的pH为5.90,请用离子方程式解释原因:NH4++H2O?NH3•H2O+H+
(4)该小组同学为探究镁与氯化铵溶液反应的原因设计了如下实验方案:
| 序号 | 实验试剂 | 实验现象 | |
| 实验1-1 | 0.20g镁粉 | 3.0mL 0.2mol/LNH4Cl溶液 | 反应明显,有气泡产生 |
| 实验1-2 | 0.20g镁粉 | 3.0mL盐酸 | 反应不明显,几乎没有气泡产生 |
A、1mol•L-1 B、pH=1.0 C、0.2mol•L-1 D、pH=5.90
②通过实验对比,说明NH4Cl水解产生的H+对反应影响小于NH4+对反应影响(填“小于”、“大于”或“等于”).
(5)该小组同学继续探究镁粉与氯化铵溶液反应剧烈的影响因素.
| 实验序号 | 实验试剂 | |
| 实验2-1 | 0.20g镁粉 | 3.0 mL 0.2mol/LNaCl溶液 |
| 实验2-2 | 0.20g镁粉 | 3.0 mL0.2mol/LNaNO3溶液 |
| 实验3-1 | 0.20g镁粉 | 3.0mL0.2mol/L NH4NO3溶液 |
| 实验3-2 | 0.20g镁粉 | 3.0mL0.2mol/L KNO3溶液 |
②实验3-1与实验3-2的结论说明NH4+对反应速率影响很大,则两支试管中实验现象的不同之处是NH4NO3溶液(左试管)和KNO3溶液(右试管)分别与Mg粉反应,左试管反应剧烈,有大量气泡生成,右试管反应很少,没有气泡生成
(6)写出镁与氯化铵溶液反应生成Mg2+的离子方程式Mg+2 NH4+=Mg2++2NH3↑+H2↑.
| A. | 明矾可用于水的杀菌,消毒 | |
| B. | 盐卤可用于制豆腐 | |
| C. | 目前加碘食盐主要添加的是KIO3 | |
| D. | 在空气质量日报中SO2含量属于空气污染指数 |
| A. | 1.6 g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1NA | |
| B. | 2.24 L CO2中含有的原子数为0.3NA | |
| C. | 相同质量的N2O4与NO2中所含原子数目不相同 | |
| D. | 100 g 17%的氨水,溶液中含有的NH3分子数为NA |