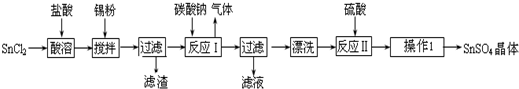
题目内容
20. 某研究性学习小组在研究二氧化硫漂白作用时,从“氯气的漂白作用实际上是氯气与水反应生成的次氯酸的漂白作用”得到启发.为了探究二氧化硫作用得到底是二氧化硫本身还是二氧化硫与水作用的产物,该小组设计了如下实验.请回答相关问题.
某研究性学习小组在研究二氧化硫漂白作用时,从“氯气的漂白作用实际上是氯气与水反应生成的次氯酸的漂白作用”得到启发.为了探究二氧化硫作用得到底是二氧化硫本身还是二氧化硫与水作用的产物,该小组设计了如下实验.请回答相关问题.(1)实验室用亚硫酸钠粉末跟硫酸制取二氧化硫,现有下列三种硫酸溶液,应选用B(填字母),理由是98%的浓硫酸H+浓度小不易反应,10%硫酸浓度太稀不利于SO2放出;
A.98%浓硫酸B.70%硫酸C.10%稀硫酸
(2)为了探究SO2能否使品红褪色,该同学选择了正确的药品后设计了如图所示实验装置,请指出实验装置设计中的不合理之处.
①不能用长颈漏斗,应改用分液漏斗;②缺少二氧化硫的干燥装置.
(3)该同学选择了正确装置后,实验中控制二氧化硫以大约每秒3个气泡的速度通过品红的酒精溶液时,经过一小时后,品红仍不褪色.为此,你认为使品红的水溶液褪色的微粒可能是HSO3-、SO32-、H2SO3.
(4)该同学进一步实验如下:取等量相同浓度的品红水溶液于两支试管中,再分别加入少量亚硫酸钠固体和亚硫酸氢钠固体,两支试管中的品红都褪色,他得出的结论:使品红褪色的微粒肯定是HSO3-或SO32-.你认为他的结论是否正确不正确,其理由是因为亚硫酸根离子和亚硫酸氢根离子都会水解生成亚硫酸.
分析 (1)根据浓硫酸和二氧化硫的性质分析,浓度大时硫酸以分子形式存在,硫酸稀时,二氧化硫易溶于水,据此分析.
(2)根据实验目的及二氧化硫的性质分析,应制取干燥的二氧化硫气体,为控制液体的量,应选取易控制流量的仪器;
(3)根据二氧化硫、品红溶液、品红酒精溶液的性质分析;
(4)亚硫酸钠和亚硫酸氢钠都能水解生成亚硫酸,根据溶液中存在的含硫微粒判断.
解答 解:(1)硫酸和亚硫酸钠固体制取二氧化硫发生的是离子反应,如果硫酸浓度过大,硫酸是以分子形式存在,没有电离出H+,不能反应生成SO2;如果硫酸浓度过低,二氧化硫易溶于水,不利于二氧化硫放出,所以选取70%硫酸,故选B,
故答案为:B;98%的浓硫酸H+浓度小不易反应,10%硫酸浓度太稀不利于SO2放出;
(2)为控制硫酸的流量应选取分液漏斗,该实验是探究干燥的SO2能不能使品红褪色,所以二氧化硫通入品红溶液前要进行干燥,
故答案为:不能用长颈漏斗,应改用分液漏斗;缺少二氧化硫的干燥装置;
(3)二氧化硫和水反应生成亚硫酸,二氧化硫和酒精不反应,二氧化硫能使品红溶液褪色而不能使品红的酒精溶液褪色,由此得出S02的漂白作用是SO2与水作用的产物导致的,二氧化硫和水反应生成亚硫酸、亚硫酸电离生成亚硫酸氢根离子、亚硫酸氢根离子电离生成亚硫酸根离子,所以使品红的水溶液褪色的微粒可能是:HSO3-、SO32-、H2SO3,
故答案为:HSO3-、SO32-、H2SO3;
(4)亚硫酸钠和亚硫酸氢钠都能水解生成亚硫酸,且亚硫酸氢根离子能电离生成亚硫酸根离子,所以两种溶液中都含有HSO3-、SO32-、H2SO3,所以不能确定使品红褪色的微粒肯定是HSO3-或SO3 2-,
故答案为:不正确;因为亚硫酸根离子和亚硫酸氢根离子都会水解生成亚硫酸.
点评 本题考查了探究二氧化硫漂白性的实验,明确各物质的性质是解本题关键,注意采用对比方法进行分析,难度较大.

| A. | 向碘水中加入适量酒精,可以将碘单质萃取出来 | |
| B. | 蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 | |
| C. | 分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 | |
| D. | 蒸发时,当溶液中出现大量晶体时,停止加热余热蒸干 |
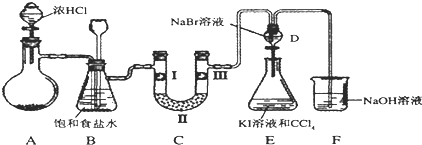
(1)若装置A中制备氯气选用的药品为固体二氧化锰和浓盐酸,请写出装置A中的化学反应方程式:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
实验室也可用高锰酸钾制氯气:2KMnO4+16HCl(浓)=5Cl2↑+2MnCl2+2KCl+8H2O
该反应中的氧化剂是KMnO4,若消耗0.2mol氧化剂,则被氧化的还原剂的物质的量是1mol;
(2)装置B中饱和食盐水的作用是除去Cl2中的HCl;
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、III依次放入d(填编号);(碱石灰为NaOH与CaO混合物,无水氯化钙为中性干燥剂)
| a | b | c | d | |
| I | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| II | 碱石灰 | 无水氯化钙 | 碱石灰 | 无水氯化钙 |
| III | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(5)装置F中用足量的NaOH溶液吸收余氯,试写出相应的化学方程式2NaOH+Cl2=NaCl+NaClO+H2O.
①金属在反应中只能作还原剂,非金属在反应中只能作氧化剂;
②氧化剂发生氧化反应;
③还原剂失去电子,化合价升高;
④溶液中的离子反应不可能是氧化还原反应;
⑤发生离子反应后,溶液的导电性减弱.
| A. | ①②④ | B. | ①③⑤ | C. | ②③⑤ | D. | 只有③ |
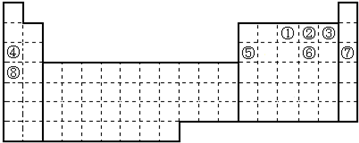
①炽热的木炭 ②H2S气体 ③Cu ④FeO ⑤NH3 ⑥蔗糖 ⑦CuSO4•5H2O ⑧铁、铝.
| A. | ③④ | B. | ①②⑤⑧ | C. | ①②③④⑦ | D. | ⑥⑦ |
| 操作和现象 | 结 论 | |
| A | 向盛有2mL0.1mol/LAgNO3溶液的试管中,先滴几滴0.1mol/LKCl溶液,再滴加0.1mol/LKI溶液.试管中先出现白色沉淀,后出现淡黄色沉淀 | Ksp(AgCl)<Ksp(AgI) |
| B | 向装有Fe(NO3)2溶液的试管中加入几滴稀H2SO4溶液颜色基本不变 | Fe(NO3)2与H2SO4不反应 |
| C | 在分液漏斗中加入碘水后再加入CCl4,充分振荡,分层,下层溶液呈紫色 | CCl4可作为碘的萃取剂 |
| D | 测定饱和NaClO溶液、CH3COONa溶液的pH,pH(NaClO)>pH(CH3COONa) | 弱酸的酸性:HClO<CH3COOH |
| A. | A | B. | B | C. | C | D. | D |
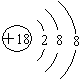 .
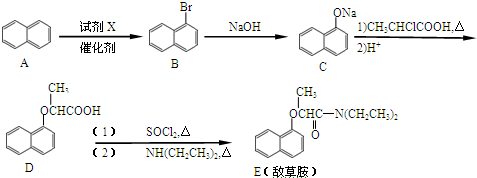
.
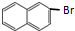 .
.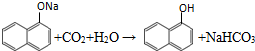 ;
;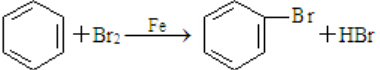 、C6H5Br+NaOH$→_{△}^{水}$C6H5OH+NaBr、C6H5ONa+CO2+H2O→C6H5OH+NaHCO3.
、C6H5Br+NaOH$→_{△}^{水}$C6H5OH+NaBr、C6H5ONa+CO2+H2O→C6H5OH+NaHCO3.