题目内容
10.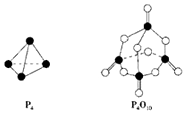 白磷与氧气可发生如下反应:P4+5O2═P4O10.已知断裂下列化学键需要吸收的能量分别为:P-P a kJ•mol-1、P-O b kJ•mol-1、P═O c kJ•mol-1、O═O d kJ•mol-1.根据图示的分子结构和有关数据估算该反应的△H,其中正确的是( )
白磷与氧气可发生如下反应:P4+5O2═P4O10.已知断裂下列化学键需要吸收的能量分别为:P-P a kJ•mol-1、P-O b kJ•mol-1、P═O c kJ•mol-1、O═O d kJ•mol-1.根据图示的分子结构和有关数据估算该反应的△H,其中正确的是( )| A. | (6a+5d-4c-12b) kJ•mol-1 | B. | (4c+12b-6a-5d) kJ•mol-1 | ||
| C. | (4c+12b-4a-5d) kJ•mol-1 | D. | (4c+5d-4a-12b) kJ•mol-1 |
分析 反应热△H=反应物总键能-生成物总键能,据此计算判断.注意每摩尔P4中含有6molP-P键.
解答 解:各化学键键能为P-P a kJ•mol-1、P-O b kJ•mol-1、P=O c kJ•mol-1、O=O d kJ•mol-1.
反应热△H=反应物总键能-生成物总键能,
所以反应P4+5O2=P4O10的反应热△H=6akJ•mol-1+5dkJ•mol-1-(4ckJ•mol-1+12bkJ•mol-1)=(6a+5d-4c-12b)kJ•mol-1,
故选:A.
点评 本题考查反应热与化学键键能的关系,难度中等,注意从物质能量、键能理解反应热.

练习册系列答案
相关题目
12.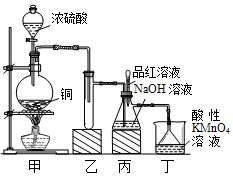 某化学兴趣小组设计实验,用浓硫酸与铜的反应制取SO2并进行相关实验探究,同时获得少量NaHSO3,实验装置如图所示:
某化学兴趣小组设计实验,用浓硫酸与铜的反应制取SO2并进行相关实验探究,同时获得少量NaHSO3,实验装置如图所示:
(1)装置甲中发生反应的化学方程式是Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,装置乙的作用是防止丙中液体倒吸入装置甲中(或缓冲瓶的作用).
(2)装置丁的作用是吸收污染空气的SO2气体,其反应的离子方程为5SO2+2MnO4-+2H2O═5SO42-+2Mn2++4H+.
(3)SO2气体有漂白性、还原性和氧化性.将SO2通入溴水中,SO2表现的是还原性,化学反应方程式为SO2+Br2+2H2O═H2SO4+2HCl.
(4)反应过程中,将丙中滴管里的品红溶液滴入锥形瓶,若现象为品红溶液褪色,则溶液中的NaOH完全转化为了NaHSO3.
(5)若丙中没有加入品红溶液,则不能准确判断氢氧化钠是否完全转化.现有可供选择的仪器和试剂:烧杯、试管、玻璃棒、胶头滴管; 2mol/L盐酸、2mol/L硝酸、1mol/L氯化钡溶液、l mol/L氢氧化钡溶液、品红溶液、蒸馏水.请设计实验探究吸收后产物中是否存在NaHSO3和Na2SO3,将实验操作、预期的实验现象和结论填在下表中.
 某化学兴趣小组设计实验,用浓硫酸与铜的反应制取SO2并进行相关实验探究,同时获得少量NaHSO3,实验装置如图所示:
某化学兴趣小组设计实验,用浓硫酸与铜的反应制取SO2并进行相关实验探究,同时获得少量NaHSO3,实验装置如图所示:(1)装置甲中发生反应的化学方程式是Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,装置乙的作用是防止丙中液体倒吸入装置甲中(或缓冲瓶的作用).
(2)装置丁的作用是吸收污染空气的SO2气体,其反应的离子方程为5SO2+2MnO4-+2H2O═5SO42-+2Mn2++4H+.
(3)SO2气体有漂白性、还原性和氧化性.将SO2通入溴水中,SO2表现的是还原性,化学反应方程式为SO2+Br2+2H2O═H2SO4+2HCl.
(4)反应过程中,将丙中滴管里的品红溶液滴入锥形瓶,若现象为品红溶液褪色,则溶液中的NaOH完全转化为了NaHSO3.
(5)若丙中没有加入品红溶液,则不能准确判断氢氧化钠是否完全转化.现有可供选择的仪器和试剂:烧杯、试管、玻璃棒、胶头滴管; 2mol/L盐酸、2mol/L硝酸、1mol/L氯化钡溶液、l mol/L氢氧化钡溶液、品红溶液、蒸馏水.请设计实验探究吸收后产物中是否存在NaHSO3和Na2SO3,将实验操作、预期的实验现象和结论填在下表中.
| 实验操作 | 预期现象与结论 |
| 步骤1:取少量待测液放入试管中,滴加过量lmol/L氯化钡溶液.静置一段时间后,得到滤液A和固体B. | |
| 步骤2:往固体B中加入蒸馏水洗涤沉淀,静置后弃去上层清液,向固体滴入2滴(或少量)品红,再滴加盐酸. | 若品红褪色(或有气泡),则说明含有Na2SO3. |
| 步骤3:用试管取少量A,向其中加入过量的氢氧化钡溶液或先加入品红再加入盐酸. | 若若生成白色沉淀或品红褪色,则说明有NaHSO3生成; 否则不存在NaHSO3. |
5.下列叙述不正确的是( )
| A. | NH3易液化,氨常用作制冷剂 | |
| B. | 胆矾遇浓硫酸变白是因为浓硫酸的脱水性 | |
| C. | 氨催化氧化制硝酸过程中的三个主要反应都属于氧化还原反应 | |
| D. | 浓硝酸需保存在棕色瓶中 |
15.下列有关化学用语表示正确的是( )
| A. | 氢氧根离子的电子式: | B. | NH4Br的电子式: | ||
| C. | Cl-的结构示意图: | D. | 过氧化钠的电子式: |
19.下列实验中,对应的现象以及结论都正确且两者具有因果关系的是( )
| 选项 | 实验 | 现象 | 结论 |
| A | 炭粉中加入浓硝酸并加热,导出的气体通入少量澄清石灰水中 | 有红棕色气体产生,石灰水变浑浊 | 有NO2和CO2产生 |
| B | FeCl3和BaCl2混合溶液中通入足量SO2 | 溶液变为浅绿色且有白色沉淀生成 | 沉淀为BaSO3 |
| C | 钠块放在石棉网上加热 | 钠块熔化,最终得淡黄色固体 | 熔点:Na2O2>Na |
| D | 蔗糖中滴入浓硫酸并不断搅拌 | 产生黑色蓬松多孔固体 | 浓硫酸具有吸水性和强氧化性 |
| A. | A | B. | B | C. | C | D. | D |
20.设NA为阿伏加德罗常数的值.下列有关叙述正确的是( )
| A. | 0.5L 2mol/L盐酸中含有NA氯化氢分子 | |
| B. | 在标准状况下,2.24L氖气含有NA个电子 | |
| C. | 常温下,24gC2H518OH分子中含有3.5NA个共价键 | |
| D. | 若2H2S+O2═2S+2H2O生成3.2g硫,则反应过程中转移0.1NA个电子 |

 .
.

