题目内容
20.设NA为阿伏加德罗常数的值.下列有关叙述正确的是( )| A. | 0.5L 2mol/L盐酸中含有NA氯化氢分子 | |
| B. | 在标准状况下,2.24L氖气含有NA个电子 | |
| C. | 常温下,24gC2H518OH分子中含有3.5NA个共价键 | |
| D. | 若2H2S+O2═2S+2H2O生成3.2g硫,则反应过程中转移0.1NA个电子 |
分析 A、盐酸溶液中无HCl分子;
B、求出氖气的物质的量,然后根据氖气中含10个电子来分析;
C、C2H518OH的摩尔质量为48g/mol,含8条共价键;
D、反应2H2S+O2═2S+2H2O转移4mol电子,生成2mol硫单质.
解答 解:A、HCl溶于水后完全电离,故盐酸溶液中无HCl分子,故A错误;
B、标况下2.24L氖气的物质的量为0.1mol,而氖气为单原子分子,故氖气中含10个电子,故0.1mol氖气中含NA个电子,故B正确;
C、C2H518OH的摩尔质量为48g/mol,故24g此种乙醇的物质的量为0.5mol,而乙醇中含8条共价键,故0.5mol乙醇中含有的共价键的条数为4NA条,故C错误;
D、反应2H2S+O2═2S+2H2O转移4mol电子,生成2mol硫单质,故当生成3.2g硫即0.1mol硫时,转移0.2mol即0.2NA个电子,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.

练习册系列答案
相关题目
10.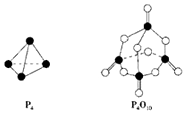 白磷与氧气可发生如下反应:P4+5O2═P4O10.已知断裂下列化学键需要吸收的能量分别为:P-P a kJ•mol-1、P-O b kJ•mol-1、P═O c kJ•mol-1、O═O d kJ•mol-1.根据图示的分子结构和有关数据估算该反应的△H,其中正确的是( )
白磷与氧气可发生如下反应:P4+5O2═P4O10.已知断裂下列化学键需要吸收的能量分别为:P-P a kJ•mol-1、P-O b kJ•mol-1、P═O c kJ•mol-1、O═O d kJ•mol-1.根据图示的分子结构和有关数据估算该反应的△H,其中正确的是( )
 白磷与氧气可发生如下反应:P4+5O2═P4O10.已知断裂下列化学键需要吸收的能量分别为:P-P a kJ•mol-1、P-O b kJ•mol-1、P═O c kJ•mol-1、O═O d kJ•mol-1.根据图示的分子结构和有关数据估算该反应的△H,其中正确的是( )
白磷与氧气可发生如下反应:P4+5O2═P4O10.已知断裂下列化学键需要吸收的能量分别为:P-P a kJ•mol-1、P-O b kJ•mol-1、P═O c kJ•mol-1、O═O d kJ•mol-1.根据图示的分子结构和有关数据估算该反应的△H,其中正确的是( )| A. | (6a+5d-4c-12b) kJ•mol-1 | B. | (4c+12b-6a-5d) kJ•mol-1 | ||
| C. | (4c+12b-4a-5d) kJ•mol-1 | D. | (4c+5d-4a-12b) kJ•mol-1 |
11.设NA为阿伏伽德罗常数的值.下列有关叙述正确的是( )
| A. | 28 g乙烯和甲烷混合气体中的氢原子数为4NA | |
| B. | 标准状况下,11.2 LCH2Cl2含有的共价键数为2NA | |
| C. | 1mol SO2与 l mol O2反应生成的SO3分子数为NA | |
| D. | 过量铜与含0.4 molHNO3的浓硝酸反应,电子转移数大于0.2NA |
8.化学与科学、技术、社会、环境密切相关,下列说法正确的是( )
| A. | 氢氧化铁胶体、淀粉溶液均具有丁达尔效应 | |
| B. | “玉不琢不成器”“百炼方能成钢”发生的均为化学变化 | |
| C. | 汽车尾气中由于汽油不完全燃烧生成的氮氧化物会造成光化学烟雾 | |
| D. | 脂昉、蛋白质、纤维素和淀粉都属于高分子化合物 |
15.有机物X可作为合成青蒿素的一种基本原料,己知X的结构如下,下列有关X的说法正确的是( )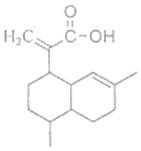

| A. | X为烃的含氧衍生物 | |
| B. | X最多可以和3mol H2发生加成反应 | |
| C. | X只能发生取代反应和加成反应 | |
| D. | X可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且褪色原理相同 |
5.在给定的条件下,下列选项所示的物质间转化均能一步实现的是( )
| A. | FeSO4(aq)$\stackrel{氢气}{→}$Fe$→_{高温}^{H_{2}O(g)}$Fe2O3 | |
| B. | Cu2S$→_{高温}^{O_{2}}$Cu$\stackrel{FeCl_{3}(aq)}{→}$CuCl2(aq) | |
| C. | Ca(OH)2$\stackrel{Cl_{2}}{→}$Ca(ClO)2$→_{H_{2}O}^{SO_{2}(足量)}$HClO | |
| D. | Fe2O3$\stackrel{HCl(aq)}{→}$FeCl3(aq)$\stackrel{△}{→}$无水FeCl3 |
3.中国古代文献记载了丰富的化学知识.下列说法不正确的是( )
| A. | “熬胆矾铁釜,久之亦化为铜”,该过程主要发生了置换反应 | |
| B. | 古剑“沈卢”,“以剂钢为刃,柔铁为茎干,不尔则多断折”,剂钢指的是铁的合金 | |
| C. | 《本草经集注》对区分硝石(硝酸钾)和硝朴(硫酸钠)有记载“以火烧之,紫青烟起,乃真硝石也”利用的是焰色反应 | |
| D. | 《周易参同契》中对汞的描述“…得火则飞,不见埃尘,将欲制之,黄芽为根”这里的“黄芽”是指过氧化钠 |