题目内容
2.我国化工专家侯德榜的“侯氏制碱法”为世界制碱工业做出了突出贡献.他利用NaHCO3、NaCl、NH4Cl等物质溶解度的差异,以食盐、氨气和二氧化碳为原料制得NaHCO3,进而生产出纯碱.Ⅰ.某研究性学习小组的同学,模拟“侯氏制碱法”提出下列一种制备NaHCO3 的实验方案,经过讨论,大家一致认为方案2较合理,请说明方案3的不足之处是二氧化碳在水(或NaCl溶液)中溶解度小,不利于NaHCO3的生成.
方案1:分别将二氧化碳和氨气通入NaCl饱和溶液中;
方案2:将二氧化碳通入含氨的NaCl饱和溶液中;
方案3:将氨气通入含二氧化碳的NaCl饱和溶液中.
Ⅱ.根据方案2,某同学设计了如下实验步骤和装置图:

步骤1:配制含氨的饱和食盐水.在100mL的锥形瓶中加人20mL氨水(体积比 1:1),再加入 8g 食盐,塞紧橡皮塞,振荡几分钟,过滤除去不溶物,得到含氨的饱和食盐水.
步骤2:制备碳酸氢钠. 按图组装实验装置,先检查装置的气密性,再向各仪器中加入相应的试剂,开始制备碳酸氢钠. 实验过程中,需要控制温度在30℃~35℃(大于35℃时NH4HCO3会分解) 和二氧化碳的通入速度(以出现能数得清的连续气泡为好).反应结束后,把锥形瓶浸入冷水中,使较多的晶体析出,过滤、洗涤.
请回答下列问题:
(1)D烧杯中稀硫酸的作用是吸收未反应的NH3.
(2)装置B中试剂是饱和碳酸氢钠溶液,它的作用为除掉二氧化碳气体中的氯化氢气体.
(3)装置C中的化学方程式为NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl.
(4)检验步骤2中所得晶体是碳酸氢钠而不是氯化钠的实验方法和现象是取少量晶体于试管中,向其中加入适量稀硝酸,反应剧烈冒出大量气泡,固体全部溶解后再滴加适量AgNO3溶液,无沉淀产生,说明得到的晶体为NaHCO3.
(5)为了检验某含有NaHCO3,杂质的Na2CO3样品的纯度,现将m1 g 样品加热,其质量变为m2 g,则样品的纯度是$\frac{84{m}_{2}-53{m}_{1}}{31{m}_{1}}$.
分析 Ⅰ.二氧化碳在水中的溶解度小,与水反应形成不稳定的碳酸,而把二氧化碳通入溶有氨气而呈碱性的水中,会使生成的碳酸与氨水发生反应,而增大二氧化碳气体的吸收;
Ⅱ.装置A:制备二氧化碳,气体中含有氯化氢气体对后续实验产生干扰,二氧化碳气体中含有氯化氢气体,会影响碳酸氢钠的生成,需要除去,装置B:除去二氧化碳中的氯化氢,装置C:NH3+H2O+CO2+NaCl=NH4Cl+NaHCO3↓,装置D:吸收尾气氨气.
(1)氨气为大气污染物,稀硫酸能与氨气反应;
(2)用盐酸制取二氧化碳时常会含有氯化氢气体,对后续实验产生干扰;
(3)碳酸氢钠的溶解度比碳酸钠小,二氧化碳通入氨化的饱和氯化钠溶液中反应生成碳酸氢钠晶体;
(4)根据氯离子的性质进行检验所得晶体是碳酸氢钠而不是氯化钠;
(5)碳酸钠性质稳定,加热不分解,碳酸氢钠热稳定性较差,加热分解导致固体质量减少,根据固体质量变化利用差量法可以计算出混合物中碳酸氢钠的质量,再计算出碳酸钠的质量及质量分数即可.
解答 解:Ⅰ.二氧化碳微溶于水,先通入二氧化碳,溶液中生成极少量的碳酸,再通入氨气,生成的产物量少,且易生成碳酸铵,氨气在水中溶解度很大,先通入氨气,溶液中生成较多的一水合氨,再通入CO2,生成的产物量多,且易生成碳酸氢铵,所以方案2较合理,方案3的不足为二氧化碳在水(或NaCl溶液)中溶解度小,不利于NaHCO3的生成,
故答案为:二氧化碳在水(或NaCl溶液)中溶解度小,不利于NaHCO3的生成;
Ⅱ.(1)氨气为大气污染物,实验过程中氨气可能有剩余,而稀硫酸能与氨气反应,所以稀硫酸的作用是吸收末反应的NH3,
故答案为:吸收未反应的NH3;
(2)利用盐酸制取二氧化碳时,因盐酸易挥发,所以,二氧化碳中常会含有氯化氢气体,会影响后续实验碳酸氢钠的生成,碳酸氢钠能与盐酸反应不与二氧化碳反应,所以通过碳酸氢钠的溶液是可以除掉二氧化碳气体中的氯化氢气体,
故答案为:饱和碳酸氢钠溶液;除掉二氧化碳气体中的氯化氢气体;
(3)二氧化碳通入氨化的饱和氯化钠溶液中反应生成碳酸氢钠晶体,反应的化学方程式:NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl,
故答案为:NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl;
(4)氯离子和银离子反应生成氯化银沉淀,所以检验步骤2中所得晶体是碳酸氢钠而不是氯化钠的实验方法为:取少量晶体于试管中,向其中加入适量稀硝酸,反应剧烈冒出大量气泡,固体全部溶解后再滴加适量AgNO3溶液,无沉淀产生,说明得到的晶体为NaHCO3,
故答案为:取少量晶体于试管中,向其中加入适量稀硝酸,反应剧烈冒出大量气泡,固体全部溶解后再滴加适量AgNO3溶液,无沉淀产生,说明得到的晶体为NaHCO3;
(5)设样品中含有NaHCO3杂质的质量为x,则
2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O?△m(减少)
2×84 106 62
x (m1g-m2g)
$\frac{2×84}{x}$=$\frac{62}{{m}_{1}-{m}_{2}}$,
解得x=$\frac{84({m}_{1}-{m}_{2})}{31}$,
则w(Na2CO3)=$\frac{{m}_{1}-x}{{m}_{1}}$=$\frac{84{m}_{2}-53{m}_{1}}{31{m}_{1}}$,
故答案为:$\frac{84{m}_{2}-53{m}_{1}}{31{m}_{1}}$.
点评 本题主要考查“侯氏制碱法”的反应原理,考查了钠的化合物性质、有关混合物反应的化学计算,题目难度中等,注意掌握碳酸钠、碳酸氢钠的化学性质,(5)明确固体质量变化的原因是解题关键,注意差量法在化学计算中的应用.

 发散思维新课堂系列答案
发散思维新课堂系列答案| A. | X与其它元素之间只能形成共价键 | |
| B. | Z元素的最高价氧化物是玻璃的主要成分,其常温下就能与强碱发生反应 | |
| C. | 非金属性Y强于Z | |
| D. | 三种元素中X的原子半径最小 |
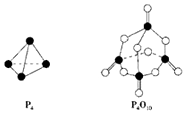 白磷与氧气可发生如下反应:P4+5O2═P4O10.已知断裂下列化学键需要吸收的能量分别为:P-P a kJ•mol-1、P-O b kJ•mol-1、P═O c kJ•mol-1、O═O d kJ•mol-1.根据图示的分子结构和有关数据估算该反应的△H,其中正确的是( )
白磷与氧气可发生如下反应:P4+5O2═P4O10.已知断裂下列化学键需要吸收的能量分别为:P-P a kJ•mol-1、P-O b kJ•mol-1、P═O c kJ•mol-1、O═O d kJ•mol-1.根据图示的分子结构和有关数据估算该反应的△H,其中正确的是( )| A. | (6a+5d-4c-12b) kJ•mol-1 | B. | (4c+12b-6a-5d) kJ•mol-1 | ||
| C. | (4c+12b-4a-5d) kJ•mol-1 | D. | (4c+5d-4a-12b) kJ•mol-1 |
| A. | 漂白粉使某些有色染料褪色 | |
| B. | 一氧化氮气体暴露在空气中变为红棕色 | |
| C. | 往黄色氯化铁溶液中投入铁粉,溶液颜色变浅 | |
| D. | 往红墨水中投入活性炭,红色褪去 |
| A. | 金属与非金属分界线附近的元素既有金属性,又有非金属性,称为过渡元素 | |
| B. | 任何元素的原子都是由核外电子和核内中子、质子组成的 | |
| C. | 118号元素是由自然界中元素衰变得到的 | |
| D. | 同种元素的不同核素之间互称同位素 |
| A. | NO3- | B. | SO32- | C. | PO43- | D. | CO32- |
| A. | 28 g乙烯和甲烷混合气体中的氢原子数为4NA | |
| B. | 标准状况下,11.2 LCH2Cl2含有的共价键数为2NA | |
| C. | 1mol SO2与 l mol O2反应生成的SO3分子数为NA | |
| D. | 过量铜与含0.4 molHNO3的浓硝酸反应,电子转移数大于0.2NA |
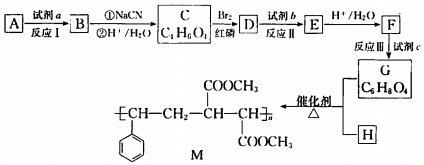
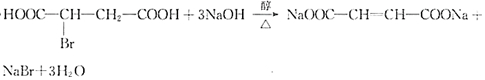 .
.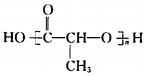 在该条件下,1mol N生成2mol I,N的结构简式是
在该条件下,1mol N生成2mol I,N的结构简式是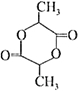 .
.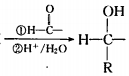 以苯和乙醛为原料制备H,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件):
以苯和乙醛为原料制备H,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件):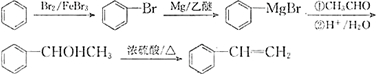 .
.