题目内容
5.下列叙述不正确的是( )| A. | NH3易液化,氨常用作制冷剂 | |
| B. | 胆矾遇浓硫酸变白是因为浓硫酸的脱水性 | |
| C. | 氨催化氧化制硝酸过程中的三个主要反应都属于氧化还原反应 | |
| D. | 浓硝酸需保存在棕色瓶中 |
分析 A.因NH3易液化吸热,液氨常用作制冷剂;
B.浓硫酸具有吸水性,能够吸收晶体中的结晶水;
C.氧化还原反应的特征是元素化合价的升降,可根据元素化合价的变化判断;
D.浓硝酸受热或见光易分解,生成二氧化氮、氧气和水.
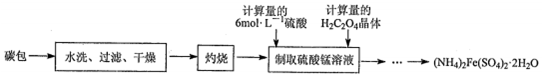
解答 解:A.氨很容易液化,液态氨汽化时要吸收大量的热,使周围物质的温度急剧下降,所以氨常作为制冷剂,故A正确;
B.胆矾遇浓硫酸变白是因为浓硫酸的吸水性,故B错误;
C.工业上制硝酸是用氨的催化氧化法,过程中有三个主要反应:4NH3+5O2 $\frac{\underline{催化剂}}{△}$4NO+6H2O,2NO+O2 ═2NO2 ,3NO2+H2O═2HNO3+NO,NH3~NO~NO2~HNO3 ,氮元素的化合价改变,所以三个反应都是氧化还原反应,故C正确;
D.浓硝酸受热或见光易分解,生成二氧化氮、氧气和水,其分解的化学方程式为:4HNO3$\frac{\underline{\;光照\;}}{\;}$4NO2+O2↑+2H2O,需保存在棕色瓶中,故D正确;
故选B.
点评 本题考查了元素化合物知识,熟悉氨的性质以及浓硫酸的强氧化性、吸水性、脱水性是解题关键,注意浓硫酸吸水性与脱水性的区别,题目难度不大.

练习册系列答案
相关题目
7.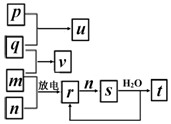 短周期主族元素X、Y、Z、W的原子序数依次增大.在如图所示的物质转化关系中,p、q、m、n分别是元素W、X、Y、Z的气体单质,p和s均为有色气体,v的水溶液呈碱性.常温下,0.1mol•L-1 t溶液与0.1mol•L-1 u溶液的pH 均为1.下列说法不正确的是( )
短周期主族元素X、Y、Z、W的原子序数依次增大.在如图所示的物质转化关系中,p、q、m、n分别是元素W、X、Y、Z的气体单质,p和s均为有色气体,v的水溶液呈碱性.常温下,0.1mol•L-1 t溶液与0.1mol•L-1 u溶液的pH 均为1.下列说法不正确的是( )
 短周期主族元素X、Y、Z、W的原子序数依次增大.在如图所示的物质转化关系中,p、q、m、n分别是元素W、X、Y、Z的气体单质,p和s均为有色气体,v的水溶液呈碱性.常温下,0.1mol•L-1 t溶液与0.1mol•L-1 u溶液的pH 均为1.下列说法不正确的是( )
短周期主族元素X、Y、Z、W的原子序数依次增大.在如图所示的物质转化关系中,p、q、m、n分别是元素W、X、Y、Z的气体单质,p和s均为有色气体,v的水溶液呈碱性.常温下,0.1mol•L-1 t溶液与0.1mol•L-1 u溶液的pH 均为1.下列说法不正确的是( )| A. | Y、W的最高价氧化物对应的水化物均为强酸 | |
| B. | 元素的非金属性:Z>Y>X,原子半径:X<Z<Y | |
| C. | s溶于水的反应中,氧化剂与还原剂的物质的量之比为1:2 | |
| D. | v的电子式可表示为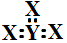 |
8.短周期主族元素X、Y、Z、W的原子序数依次增大,X元素原子最外层电子数是内层的2倍,Y是地壳中含量最高的元素,W的原子序数是Y的2倍,X、Y、Z、W最外层电子数之和为19.下列说法正确的是( )
| A. | X和Y只能形成一种化合物 | |
| B. | 原子半径:r(Z)>r(W)>r(Y) | |
| C. | W的简单气态氢化物的热稳定性比Y强 | |
| D. | 元素Z、W的简单离子具有相同的电子层结构 |
10.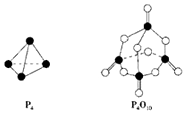 白磷与氧气可发生如下反应:P4+5O2═P4O10.已知断裂下列化学键需要吸收的能量分别为:P-P a kJ•mol-1、P-O b kJ•mol-1、P═O c kJ•mol-1、O═O d kJ•mol-1.根据图示的分子结构和有关数据估算该反应的△H,其中正确的是( )
白磷与氧气可发生如下反应:P4+5O2═P4O10.已知断裂下列化学键需要吸收的能量分别为:P-P a kJ•mol-1、P-O b kJ•mol-1、P═O c kJ•mol-1、O═O d kJ•mol-1.根据图示的分子结构和有关数据估算该反应的△H,其中正确的是( )
 白磷与氧气可发生如下反应:P4+5O2═P4O10.已知断裂下列化学键需要吸收的能量分别为:P-P a kJ•mol-1、P-O b kJ•mol-1、P═O c kJ•mol-1、O═O d kJ•mol-1.根据图示的分子结构和有关数据估算该反应的△H,其中正确的是( )
白磷与氧气可发生如下反应:P4+5O2═P4O10.已知断裂下列化学键需要吸收的能量分别为:P-P a kJ•mol-1、P-O b kJ•mol-1、P═O c kJ•mol-1、O═O d kJ•mol-1.根据图示的分子结构和有关数据估算该反应的△H,其中正确的是( )| A. | (6a+5d-4c-12b) kJ•mol-1 | B. | (4c+12b-6a-5d) kJ•mol-1 | ||
| C. | (4c+12b-4a-5d) kJ•mol-1 | D. | (4c+5d-4a-12b) kJ•mol-1 |
17.下列颜色变化不是因为发生化学变化而产生的是( )
| A. | 漂白粉使某些有色染料褪色 | |
| B. | 一氧化氮气体暴露在空气中变为红棕色 | |
| C. | 往黄色氯化铁溶液中投入铁粉,溶液颜色变浅 | |
| D. | 往红墨水中投入活性炭,红色褪去 |
14.下列各微粒中,与SO42-互为等电子体的是( )
| A. | NO3- | B. | SO32- | C. | PO43- | D. | CO32- |
15.有机物X可作为合成青蒿素的一种基本原料,己知X的结构如下,下列有关X的说法正确的是( )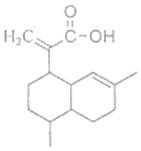

| A. | X为烃的含氧衍生物 | |
| B. | X最多可以和3mol H2发生加成反应 | |
| C. | X只能发生取代反应和加成反应 | |
| D. | X可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且褪色原理相同 |
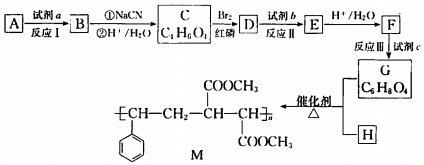
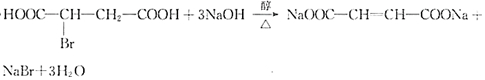 .
.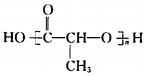 在该条件下,1mol N生成2mol I,N的结构简式是
在该条件下,1mol N生成2mol I,N的结构简式是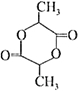 .
.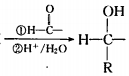 以苯和乙醛为原料制备H,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件):
以苯和乙醛为原料制备H,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件):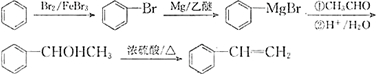 .
.