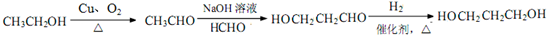题目内容
10.下列各组物质反应后,溶液的导电性比反应前明显增加的是(忽略溶液体积变化)( )| A. | 向0.1mol/L NaOH溶液滴加醋酸 | |
| B. | 向氢硫酸饱和溶液中通入氯气 | |
| C. | 向氯化铜溶液中加入适量氢氧化钡溶液 | |
| D. | 向硝酸银溶液通入氯化氢气体 |
分析 电解质溶液的导电性与离子浓度成正比、与电荷成正比,溶液导电性比反应前明显增加,说明溶液中离子浓度比反应前明显增加,据此分析解答.
解答 A.NaOH是强电解质,加入醋酸后,二者反应生成强电解质醋酸钠,离子浓度变化不大,所以溶液导电性与反应前变化不大,故A错误;
B.氢硫酸为弱电解质,加入氯气后,二者反应生成氯化氢和S,弱电解质变为强电解质,溶液中离子浓度变化较大,所以其溶液导电性比反应前明显增加,故B正确;
C.向氯化铜溶液中加入适量氢氧化钡溶液,二者反应生成氢氧化铜程度和氯化钡,氯化钡和氯化铜都是强电解质,因为体积体积增大,所以反应前后离子浓度减小,则溶液导电性减弱,故C错误;
D.硝酸银是强电解质,硝酸银溶液中通入氯化氢,生成氯化银沉淀和硝酸,硝酸是强电解质,反应前后离子浓度变化不大,所以溶液导电性变化不大,故D错误;
故选B.
点评 本题考查溶液导电性,为高频考点,明确物质性质及溶液导电性强弱影响因素是解本题关键,注意:溶液导电性强弱与离子浓度有关,与电解质强弱无关.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
1.下列离子方程式书写正确的是( )
| A. | 钠与水反应:Na+H2O═Na++OH-+H2↑ | |
| B. | 硫酸铜溶液与氢氧化钡溶液反应:Ba2++SO42-═BaSO4↓ | |
| C. | AlCl3溶液中加入过量氨水:Al3++4OH-═AlO2-+2H2O | |
| D. | 用FeCl3溶液腐蚀印刷电路板:2Fe3++Cu═2Fe2++Cu2+ |
18.将amol NaHCO3和bmol Na2O2固体混合后,在密闭容器中加热到250℃,让其充分反应.当剩余固体为Na2CO3、NaOH,排出气体为O2、H2O时,$\frac{a}{b}$的值可能为( )
| A. | 1.0 | B. | 1.35 | C. | 1.5 | D. | 2.0 |
2.不能由铁与非金属单质直接化合而成的物质是( )
| A. | Fe304 | B. | FeCl3 | C. | FeCl2 | D. | FeS |
19.下列化学用语表示正确的是( )
| A. | 甲基的电子式: | B. | 乙炔的最简式:C2H2 | ||
| C. | 乙醛的结构简式:CH3COH | D. | 苯分子的比例模型: |
20.氯碱工业电解所用的氯化钠溶液需精制.除去有影响的Ca2+,Mg2+,NH4+,SO42-及泥沙,其精制流程如下:
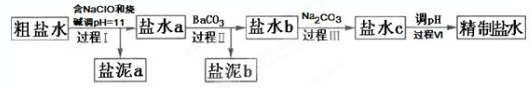
已知:①Ca2+,Mg2+开始形成相应氢氧化物沉淀的pH如表:
②Ksp(BaSO4)=1.1×10-10,Ksp(BaCO3)=2.6×10-9,Ksp(CaCO3)=5.0×10-9.
下列说法正确的是( )

已知:①Ca2+,Mg2+开始形成相应氢氧化物沉淀的pH如表:
| Ca(OH)2 | Mg(OH)2 | |
| pH | ≥11.5 | ≥4.2 |
下列说法正确的是( )
| A. | 盐泥a除泥沙外,还含有Ca(OH)2和Mg(OH)2 | |
| B. | 过程Ⅰ中NH4+转化为N2的离子方程式是3ClO-+2NH4+═3Cl-+N2↑+3H2O+2H+ | |
| C. | 过程Ⅱ中通入CO2有利于除SO42- | |
| D. | 过程Ⅳ调pH可以使用硝酸 |
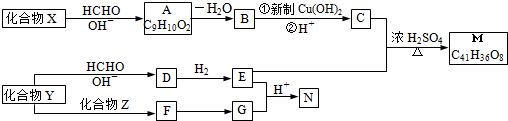
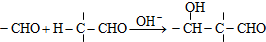
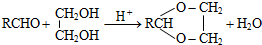
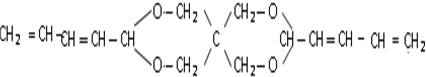
 Z:CH2=CHCHO E:
Z:CH2=CHCHO E:
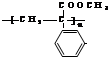 .
.