题目内容
9.某气态烷烃与烯烃的混合气9g,其密度为相同状况下氢气密度的11.2倍,将混合气体通过足量的溴水,溴水增重4.2g,求:(1)混合气体的平均摩尔质量为22.4 g•mol-1.
(2)下列关于混合气体组成,判断正确的是A(填字母编号)
A.必有甲烷 B.必有乙烯 C.无法判断
(3)气态烯烃的物质的量0.1mol.
分析 (1)根据气体密度与摩尔质量成正比计算出该混合气体的平均摩尔质量;
(2)根据烯烃的相对分子质量及混合气体的平均摩尔质量判断气体组成;
(3)4.2g为烯烃的质量,根据n=$\frac{m}{M}$计算混合气体总物质的量、甲烷的物质的量,进而计算烯烃的物质的量.
解答 解:(1)混合气体密度为同状况下H2密度的11.2倍,摩尔质量与密度成正比,则混合气体的平均摩尔质量为:2g/mol×11.2=22.4g/mol,
故答案为:22.4;
(2)混合气体的平均摩尔质量为22.4g/mol,烯烃中最简单为乙烯,其相对分子质量为28,大于22.4,故一定含有甲烷,
故答案为:A;
(2)混合气体总物质的量=$\frac{9g}{22.4g/mol}$=$\frac{9}{22.4}$mol,将混合气体通过足量的溴水,溴水增重4.2g为烯烃的质量,甲烷的质量为:9g-4.2g=4.8g,
甲烷的物质的量=$\frac{4.8g}{16g/mol}$=0.3mol,则烯烃的物质的量为:0.4mol-0.3mol=0.1mol,
故答案为:0.1mol.
点评 本题考查了混合物反应的计算,题目难度中等,明确相对密度与摩尔质量的关系为解答关键,注意掌握常见有机物结构与性质,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案
相关题目
17.下列粒子在化学反应中既能显示氧化性又能显示还原性的是( )
| A. | Fe3+ | B. | Cl- | C. | Al | D. | H2O2 |
4.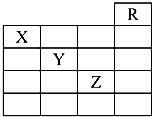 如图是元素周期表的一部分,关于元素X、Y、Z的叙述中,正确的个数是( )
如图是元素周期表的一部分,关于元素X、Y、Z的叙述中,正确的个数是( )
①X的气态氢化物与Y的最高价氧化物对应的水化物能发生反应生成盐
②Y、Z的气态氢化物水溶液的均显酸性
③Z的单质在常温下是液体
④Z所在的周期中含有32种元素.
 如图是元素周期表的一部分,关于元素X、Y、Z的叙述中,正确的个数是( )
如图是元素周期表的一部分,关于元素X、Y、Z的叙述中,正确的个数是( )①X的气态氢化物与Y的最高价氧化物对应的水化物能发生反应生成盐
②Y、Z的气态氢化物水溶液的均显酸性
③Z的单质在常温下是液体
④Z所在的周期中含有32种元素.
| A. | 4个 | B. | 3个 | C. | 2个 | D. | 1个 |
14.NA表示阿伏加德罗常数,下列判断正确的是( )
| A. | 任何状况下,78克过氧化钠的分子数为NA | |
| B. | 标况下,22.4L氯气在任何反应中转移电子数均为2NA | |
| C. | 标况下,22.4L水中含水分子为NA | |
| D. | 含NA个Na+的Na2O溶解于水配成1L溶液中,Na+的物质的量浓度为1mol•L-1 |
1.下列离子方程式书写正确的是( )
| A. | 钠与水反应:Na+H2O═Na++OH-+H2↑ | |
| B. | 硫酸铜溶液与氢氧化钡溶液反应:Ba2++SO42-═BaSO4↓ | |
| C. | AlCl3溶液中加入过量氨水:Al3++4OH-═AlO2-+2H2O | |
| D. | 用FeCl3溶液腐蚀印刷电路板:2Fe3++Cu═2Fe2++Cu2+ |
18.将amol NaHCO3和bmol Na2O2固体混合后,在密闭容器中加热到250℃,让其充分反应.当剩余固体为Na2CO3、NaOH,排出气体为O2、H2O时,$\frac{a}{b}$的值可能为( )
| A. | 1.0 | B. | 1.35 | C. | 1.5 | D. | 2.0 |
19.下列化学用语表示正确的是( )
| A. | 甲基的电子式: | B. | 乙炔的最简式:C2H2 | ||
| C. | 乙醛的结构简式:CH3COH | D. | 苯分子的比例模型: |
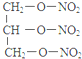 +3H2O.
+3H2O.