题目内容
目前市场销售的某种食用精制盐包装袋上有如下说明:
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式(将化学计量数填于空白处)
KIO3+ KI+ H2SO4= K2SO4+ I2+ H2O
(2)上述反应生成的I2可用四氯化碳检验.向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳.
①Na2SO3稀溶液与I2反应的离子方程式是 .
②某学生设计回收四氯化碳的操作步骤为:
a.将碘的四氯化碳溶液置于分液漏斗中;
b.加入适量Na2SO3稀溶液;
c.分离出下层液体.
以上设计中遗漏的操作及在上述步骤中的位置是 .
(3)已知:I2+2S2O32-=2I-+S4O62-.某学生测定食用精制盐的碘含量,其步骤为:
a.准确称取wg食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,逐滴加入物质的量浓度为1.00×10-3mol?L-1的Na2S2O3溶液24.00mL,恰好反应完全.
①判断c中反应恰好完全依据的现象是 .
②b中反应所产生的I2的物质的量是 mol.
③根据以上实验和包装袋说明,所测精制盐的碘含量是(以含w的代数式表示) mg/kg.
| 产品标准 | GB5461 |
| 产品等级 | 一级 |
| 配料 | 食盐、碘酸钾、抗结剂 |
| 碘含量(以I计) | 20~50mg/kg |
| 分装日期 | |
| 分装企业 |
(2)上述反应生成的I2可用四氯化碳检验.向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳.
①Na2SO3稀溶液与I2反应的离子方程式是
②某学生设计回收四氯化碳的操作步骤为:
a.将碘的四氯化碳溶液置于分液漏斗中;
b.加入适量Na2SO3稀溶液;
c.分离出下层液体.
以上设计中遗漏的操作及在上述步骤中的位置是
(3)已知:I2+2S2O32-=2I-+S4O62-.某学生测定食用精制盐的碘含量,其步骤为:
a.准确称取wg食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,逐滴加入物质的量浓度为1.00×10-3mol?L-1的Na2S2O3溶液24.00mL,恰好反应完全.
①判断c中反应恰好完全依据的现象是
②b中反应所产生的I2的物质的量是
③根据以上实验和包装袋说明,所测精制盐的碘含量是(以含w的代数式表示)
考点:氧化还原反应方程式的配平,化学方程式的有关计算,氯、溴、碘及其化合物的综合应用
专题:计算题
分析:(1)该反应中,KIO3中I元素化合价由+5价变为0价、KI中I元素化合价由-1价变为0价,根据转移电子相等配平方程式;
(2)①I2具有氧化性,能将SO32-氧化为SO42-,自身被还原为I-;
②如果不振荡,二者反应不充分;
(3)①二者恰好反应时,溶液由蓝色恰好变为无色;
②根据I2+2S2O32-=2I-+S4O62-中碘和硫代硫酸钠之间的关系式计算但的物质的量;
③根据碘和食盐质量之比进行计算.
(2)①I2具有氧化性,能将SO32-氧化为SO42-,自身被还原为I-;
②如果不振荡,二者反应不充分;
(3)①二者恰好反应时,溶液由蓝色恰好变为无色;
②根据I2+2S2O32-=2I-+S4O62-中碘和硫代硫酸钠之间的关系式计算但的物质的量;
③根据碘和食盐质量之比进行计算.
解答:
解:(1)该反应中,KIO3中I元素化合价由+5价变为0价、KI中I元素化合价由-1价变为0价,转移电子总数为5,再结合原子守恒配平方程式为KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O,故答案为:1;5;3;3;3;3;
(2)①I2具有氧化性,能将SO32-氧化为SO42-,自身被还原为I-,离子方程式为I2+SO32-+H2O=2I-+SO42-+2H+,故答案为:I2+SO32-+H2O=2I-+SO42-+2H+;
②如果不振荡,二者反应不充分,所以在步骤b后,增加操作:将分液漏斗充分振荡后静置,故答案为:在步骤b后,增加操作:将分液漏斗充分振荡后静置;
(3)①碘遇淀粉试液变蓝色,如果碘完全反应,则溶液会由蓝色转化为无色,所以当溶液由蓝色转化为无色时说明反应完全,故答案为:溶液由蓝色恰好变为无色;
②设碘的物质的量为x,
I2+2S2O32-=2I-+S4O62-
1mol 2mol
x 1.00×10-3mol?L-1×0.024L
1mol:2mol=x:(1.00×10-3mol?L-1×0.024L)
x=
=1.2×10-5mol,
故答案为:1.2×10-5;
③根据KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O得
n(I2)=(KIO3)=4×10-6mol,碘酸钾中碘的质量=4×10-6mol×127g/mol=0.508mg,
设每kg食盐中碘的质量为y,
则y:1000g=0.508mg:wg,
y=
=
mg或
mg,
故答案为:
或
.
(2)①I2具有氧化性,能将SO32-氧化为SO42-,自身被还原为I-,离子方程式为I2+SO32-+H2O=2I-+SO42-+2H+,故答案为:I2+SO32-+H2O=2I-+SO42-+2H+;
②如果不振荡,二者反应不充分,所以在步骤b后,增加操作:将分液漏斗充分振荡后静置,故答案为:在步骤b后,增加操作:将分液漏斗充分振荡后静置;
(3)①碘遇淀粉试液变蓝色,如果碘完全反应,则溶液会由蓝色转化为无色,所以当溶液由蓝色转化为无色时说明反应完全,故答案为:溶液由蓝色恰好变为无色;
②设碘的物质的量为x,
I2+2S2O32-=2I-+S4O62-
1mol 2mol
x 1.00×10-3mol?L-1×0.024L
1mol:2mol=x:(1.00×10-3mol?L-1×0.024L)
x=
| 1.00×10-3mol/L×0.024L×1mol |
| 2mol |
故答案为:1.2×10-5;
③根据KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O得
| 1 |
| 3 |
设每kg食盐中碘的质量为y,
则y:1000g=0.508mg:wg,
y=
| 1000g×0.508mg |
| wg |
| 5.08×10-2 |
| w |
| 508 |
| w |
故答案为:
| 5.08×10-2 |
| w |
| 508 |
| w |
点评:本题考查氧化还原反应方程式的配平、物质的量的有关计算等知识点,根据转移电子相等、原子守恒配平方程式即可,注意(2)中生成的碘不完全来自于碘酸钾,还来自于碘化钾,为易错点.

练习册系列答案
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案
相关题目
NaNO2是一种食品添加剂,它能致癌,酸性KMnO4溶液与NaNO2反应的离子方程式为MnO4-+NO2-+H+-Mn2++□+H2O (未配平).下列叙述正确的是( )
| A、反应后溶液pH下降 |
| B、通常用盐酸酸化的高锰酸钾溶液 |
| C、方框中粒子为NO2 |
| D、当生成1 mol Mn2+ 需消耗2.5 mol NO2- |
某溶液仅含Fe2+、Na+、Al3+、Ba2+、SO42-、NO3-、Cl-中的4种离子,所含离子的物质的量均为1mol.若向该溶液中加入过量的稀H2SO4,有气泡产生,且溶液中阴离子种类不变(不考虑水的电离和离子的水解).下列说法正确的是( )
| A、若向该溶液中加入足量的NaOH溶液,充分反应后过滤、洗涤、灼烧,最终所得固体质量为72g |
| B、若向该溶液中加入过量的稀H2SO4,产生的气体遇空气能变成红棕色 |
| C、若向该溶液中加入过量的稀H2SO4和KSCN溶液,溶液不显血红色 |
| D、该溶液中所含的离子是:Fe2+、Ba2+、SO42-、NO3- |
下列电子排布图中,属于基态碳的是( )
A、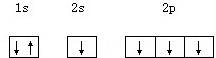 |
B、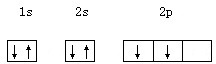 |
C、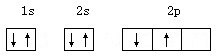 |
D、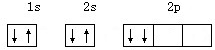 |