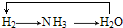题目内容
17.氯气是一种重要的化工原料.工业上常用反应3Cl2+8NH3═N2+6NH4Cl检验氯气管道是否漏气.根据材料中的反应回答下列问题:(1)氧化剂是Cl2,还原剂是NH3.
(2)氧化剂与被氧化的还原剂分子个数比为3:2.
分析 3Cl2+8NH3═N2+6NH4Cl中,N元素的化合价升高,Cl元素的化合价降低,该反应转移6e-,以此来解答.
解答 解:(1)N元素的化合价升高,Cl元素的化合价降低,则氧化剂为Cl2,还原剂为NH3,故答案为:Cl2;NH3;
(2)该反应转移6e-,3molCl2得到电子与2molNH3失去电子转移电子相同,则氧化剂与被氧化的还原剂分子个数比为3:2,故答案为:3:2.
点评 本题考查氧化还原反应及计算,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,注意氧化剂与还原剂转移电子守恒,题目难度不大.

练习册系列答案
 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案
相关题目
8.根据表中7种短周期元素的有关信息判断,下列说法错误的是( )
| 元素编号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ |
| 原子半径/nm | 0.037 | 0.074 | 0.082 | 0.099 | 0.102 | 0.143 | 0.152 |
| 最高化合价或最低化合价 | +1 | -2 | +3 | -1 | -2 | +3 | +1 |
| A. | 元素④气态氢化物的稳定性大于元素⑤气态氢化物的稳定性 | |
| B. | 元素②氢化物的沸点小于元素⑤氢化物的沸点 | |
| C. | 元素②⑥形成的化合物具有两性 | |
| D. | ⑦①可形成离子化合物 |
5.短周期元素X、Y、Z在元素周期表中的位置如图所示,下列说法正确的是( )
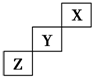

| A. | X、Y、Z三种元素中,X的非金属性最强 | |
| B. | Y的氢化物的稳定性比Z的弱 | |
| C. | Y的最高正化合价为+7 | |
| D. | X的单质不易发生化学反应 |
12.下列物质既能发生消去反应,又能氧化成醛的是( )
| A. | CH3CH2CH2OH | B. | (CH3)3CCH2OH | C. | HOCH2CHBrCH3 | D. | CH3OH |
2.以下指定溶液中有关离子的物质的量浓度关系正确的是( )
| A. | pH=2的HA溶液与pH=12的MOH溶液以任意比混合:c(H+)+c(M+)>c(OH-)+c(A-) | |
| B. | pH相等的CH3COONa、NaOH和Na2CO3三种溶液的物质的量浓度:c(NaOH)<c(CH3COONa)<c(Na2CO3) | |
| C. | 物质的量浓度相等的CH3COOH和CH3COONa两溶液等体积混合:c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH) | |
| D. | 0.1 mol•L-1的NaHA溶液,测得pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-) |
9.下列说法正确的是( )
| A. | 漂白粉的有效成分是氯酸钙 | |
| B. | 将过量铁粉加入稀硝酸中,有气体生成,充分反应后滴加KSCN溶液,溶液呈血红色 | |
| C. | 将铜粉加1.0mol•L-1Fe2(SO4)3溶液中,溶液变蓝、有黑色固体出现 | |
| D. | 二氧化硅是制造光导纤维的材料 |
6.在标准状况下,将CO2和CO的混合气体(标准状况下,该混合气体平均相对分子质量为32)充满一盛有足量Na2O2的容积为22.4L的密闭容器中,用间断的电火花引发至充分反应.反应完全后容器里的存在物叙述正确的是( )
| A. | 存在0.5 mol的CO | B. | 存在0.25 mol的Na2CO3 | ||
| C. | 存在0.125 mol的O2 | D. | 存在0.75 mol的Na2CO3 |
7.短周期元素W、X、Y和Z的原子序数依次增大.其中W的原子半径最小,X的一种核素在考古时常用来鉴定一些文物的年代,工业上采用液态空气分馏方法来生产Y的单质,且Y和Z可以形成化合物ZY2和ZY3.根据以上叙述,下列说法中正确的是( )
| A. | 原子半径大小为W<X<Y<Z | |
| B. | W与X、Y、Z分别形成最简单化合物中最稳定的是Z | |
| C. | W与Y可形成既含极性共价键又含非极性共价键的化合物 | |
| D. | 由W与X组成的化合物的沸点总低于由W与Y组成的化合物的沸点 |