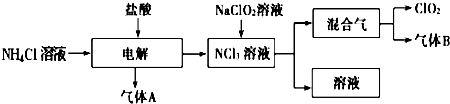
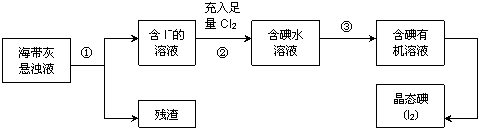
题目内容
1.下列各组物质不能按“→”所示关系实现转化的是(“→”表示反应一步完成)( )| A. | 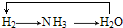 | B. | 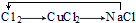 | ||
| C. | 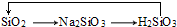 | D. | 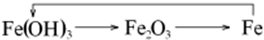 |
分析 A.氢气与氮气反应生成氨气,氨气催化氧化生成水和一氧化氮,电解水生成氢气;
B.氯气与铜反应生成氯化铜,氯化铜与氢氧化钠反应生成氯化钠和氢氧化铜沉淀,电解熔融的氯化钠生成氯气和钠;
C.二氧化硅与氢氧化钠反应生成硅酸钠,硅酸钠与盐酸反应生成硅酸,硅酸分解生成二氧化硅;
D.氢气与氮气反应生成氨气,氨气催化氧化生成水和一氧化氮,电解水生成氢气.
解答 解:A.氢气与氮气反应生成氨气,氨气催化氧化生成水和一氧化氮,电解水生成氢气,所以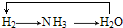 能够实现转化,故A不选;
能够实现转化,故A不选;
B.氯气与铜反应生成氯化铜,氯化铜与氢氧化钠反应生成氯化钠和氢氧化铜沉淀,所以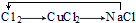 能够实现转化,故B不选;
能够实现转化,故B不选;
C.二氧化硅与氢氧化钠反应生成硅酸钠,硅酸钠与盐酸反应生成硅酸,硅酸分解生成二氧化硅,所以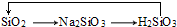 能够实现转化,故C不选;
能够实现转化,故C不选;
D.铁不能一步反应生成氢氧化铁,所以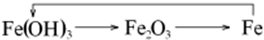 不能够实现转化,故D选;
不能够实现转化,故D选;
故选:D.
点评 本题考查了物质之间的转化,明确相关物质的性质和发生的反应是解题关键,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
11.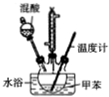 2-硝基甲苯和4-硝基甲苯均可用于印染行业,实验室利用下列反应和装置制备这两种物质
2-硝基甲苯和4-硝基甲苯均可用于印染行业,实验室利用下列反应和装置制备这两种物质
实验中可能用到的数据:
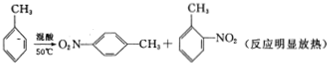
实验步骤:①按体积比3:1配制浓硫酸与浓硝酸混合物40mL;
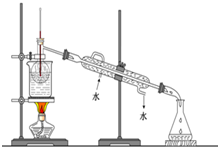
②在三颈瓶中加入20.0mL甲苯,按图所示装好药品和其他仪器;
③向三颈瓶中加入混酸,并不断搅拌(磁力搅拌器已略去);
④控制温度约为50℃,反应大约10min,三颈瓶底有大量淡黄色油状液体出现;
⑤分离出2-硝基甲苯和4-硝基甲苯并称重,其总总质量为13.7g.
(1)在烧杯中配制该实验所需混酸的方法是分别量取10 mL和30 mL的浓硫酸和浓硝酸,将浓硝酸倒入烧杯中,浓硫酸沿着烧杯内壁缓缓注入,并不断搅拌.
(2)步骤④的关键是控制温度,其措施有水浴加热、充分搅拌和控制滴加混酸的速度
分离产物的方案如下:
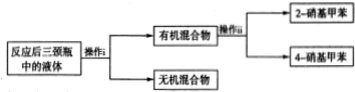
回答下列问题:
操作ii中会用到下列仪器中的ac(填序号).
a.温度计b.蒸发皿c.锥形瓶d.分液漏斗
该实验中2-硝基甲苯和4-硝基甲苯的总产率为53.2%.
(4)实验中的无机混合物可以回收再利用,回收前需要测定各成分的浓度,取10.00mL无机混合物,加水稀释至100.00mL待用,取稀释液10.00mL,用0.1000mol•L-1NaOH溶液滴定至溶液呈中性,消化NaOH溶液VmL,另取稀释液10.00mL,加入过量BaCl2溶液,充分反应后过滤并将滤渣洗涤、干燥后称重,质量为Wg.
①取10.00mL稀释液的过程中,酸式滴定管的初始液面为0.20mL,左手控制活塞向锥形瓶中加稀释液,此时眼睛应该平视10.20mL的刻度线.
②设计简单实验证明滤渣已经洗涤干净:取适量最后一次洗涤液于试管中,加入硝酸银,若不产生白色沉淀,则证明洗涤干净
③原无机混合物中HNO3的浓度为0.1V-$\frac{2000w}{233}$mol•L-1(用含V和W的代数式表示)
 2-硝基甲苯和4-硝基甲苯均可用于印染行业,实验室利用下列反应和装置制备这两种物质
2-硝基甲苯和4-硝基甲苯均可用于印染行业,实验室利用下列反应和装置制备这两种物质实验中可能用到的数据:

| 相对分子质量 | 密度/g•cm-3 | 沸点/℃ | 溶解性 | |
| 甲苯 | 92 | 0.866 | 110.6 | 不溶于水,易溶于硝基甲苯 |
| 2-硝基甲苯 | 137 | 1.162 | 222 | 不溶于水,易溶于液态烃 |
| 4-硝基甲苯 | 137 | 1.286 | 237.7 | 不溶于水,易溶于液态烃 |
②在三颈瓶中加入20.0mL甲苯,按图所示装好药品和其他仪器;
③向三颈瓶中加入混酸,并不断搅拌(磁力搅拌器已略去);
④控制温度约为50℃,反应大约10min,三颈瓶底有大量淡黄色油状液体出现;
⑤分离出2-硝基甲苯和4-硝基甲苯并称重,其总总质量为13.7g.
(1)在烧杯中配制该实验所需混酸的方法是分别量取10 mL和30 mL的浓硫酸和浓硝酸,将浓硝酸倒入烧杯中,浓硫酸沿着烧杯内壁缓缓注入,并不断搅拌.
(2)步骤④的关键是控制温度,其措施有水浴加热、充分搅拌和控制滴加混酸的速度
分离产物的方案如下:

回答下列问题:
操作ii中会用到下列仪器中的ac(填序号).
a.温度计b.蒸发皿c.锥形瓶d.分液漏斗
该实验中2-硝基甲苯和4-硝基甲苯的总产率为53.2%.
(4)实验中的无机混合物可以回收再利用,回收前需要测定各成分的浓度,取10.00mL无机混合物,加水稀释至100.00mL待用,取稀释液10.00mL,用0.1000mol•L-1NaOH溶液滴定至溶液呈中性,消化NaOH溶液VmL,另取稀释液10.00mL,加入过量BaCl2溶液,充分反应后过滤并将滤渣洗涤、干燥后称重,质量为Wg.
①取10.00mL稀释液的过程中,酸式滴定管的初始液面为0.20mL,左手控制活塞向锥形瓶中加稀释液,此时眼睛应该平视10.20mL的刻度线.
②设计简单实验证明滤渣已经洗涤干净:取适量最后一次洗涤液于试管中,加入硝酸银,若不产生白色沉淀,则证明洗涤干净
③原无机混合物中HNO3的浓度为0.1V-$\frac{2000w}{233}$mol•L-1(用含V和W的代数式表示)
12.化学与科学、技术、社会、环境密切相关,下列说法正确的是( )
| A. | 研制乙醇汽油技术,能够降低机动车尾气中有害气体的排放 | |
| B. | 联合制碱法生产纯碱时,在饱和食盐水中先通入二氧化碳,再通入氨气 | |
| C. | 接触法制备硫酸的过程中,在吸收塔内是用大量的水吸收三氧化硫 | |
| D. | 工业上通过电解熔融氧化铝制备金属铝时,常常加入冰晶石作助熔剂 |
9.下列现象或事实可用同一原理解释的是( )
| A. | 浓硫酸和浓盐酸长期暴露在空气中浓度降低 | |
| B. | SO2和FeSO4溶液使酸性高锰酸钾的紫色褪去 | |
| C. | 漂白粉、活性炭、Na2O2都能使红墨水褪色 | |
| D. | 亚硫酸钠溶液和氯化铝溶液在空气中蒸干不能得到对应的溶质 |
6.下列哪种物质可以鉴别乙醇和乙醛( )
| A. | 新制氢氧化铜 | B. | 碳酸钠溶液 | C. | 高锰酸钾溶液 | D. | FeCl3溶液 |
13.下列说法不正确的是( )
| A. | 氟氯烃的肆意排放会加速臭氧层的破坏,使大气层中的紫外线增强 | |
| B. | 不慎将苯酚沾到皮肤上应立即用酒精清洗 | |
| C. | 淀粉、蛋白质、油脂均是天然高分子化合物 | |
| D. | 除去乙酸乙酯中少量的乙酸:用饱和碳酸钠溶液洗涤后分液、干燥、蒸馏即可 |