题目内容
17.下列有关研究化学反应原理的叙述中,正确的是( )| A. | 研究化学反应中的能量变化,有利于通过改变反应条件,使同一反应消耗相同量的物质而放出更多的热,提高化学能的利用率 | |
| B. | 任何放热的化学反应,均可以利用原电池直接把化学能转化为电能 | |
| C. | 研究化学反应速率与化学平衡,有利于指导实际生产中达到“多,快,好,省”的生产效率 | |
| D. | 使用催化剂常常可以加快化学反应速率,但不能提高反应物的转化率,因此在实际生产中较少使用催化剂 |
分析 A、使同一反应消耗相同量的物质,放出的热量是一定值;
B、任何放热的氧化还原反应;
C、研究化学反应速率来缩短反应的时间与研究化学平衡来提高转化率;
D、催化剂加快化学反应速率,化学平衡不移动,而在实际生产中结合生产实际选用合适的催化剂.
解答 解:A、反应热的大小与反应物和生成物的总能量的大小有关,所以对于同一反应消耗相同量的物质,放出的热量是一定值,故A错误;
B、原电池的负极失电子,电子经外电路流入正极,正极发生还原反应,所以必须是放热的氧化还原反应,故B错误;
C、研究化学反应速率来缩短反应的时间与研究化学平衡来提高转化率,从而有利于指导实际生产中达到“多,快,好,省”的生产效率,故C正确;
D、催化剂加快化学反应速率,化学平衡不移动,而在实际生产中结合生产实际选用合适的催化剂,故D错误;
故选C.
点评 本题考查化学反应的基本原理,明确影响反应速率的因素,和平衡移动的因素是解答本题的关键,结合生产实际分析解答,题目难度不大.

练习册系列答案
相关题目
7.下列大小比较不正确的是( )
| A. | 熔沸点:SiO2>NaCl>S>CO2 | B. | 酸性:HNO2<HNO3;H3PO4<H2SO4 | ||
| C. | 还原性:H2S>HI>HBr>HCl | D. | 键长:C-H<N-H<O-H |
8.13.7g的Na2CO3与NaHCO3的固体混合物,在空气中加热片刻后固体混合物质量变为12g,将所得的固体混合物溶于200mL、1mol•L-1的稀盐酸恰好完全反应,并完全放出二氧化碳气体,将所得的溶液蒸干、灼烧称量,其质量为( )
| A. | 11.7g | B. | 23.4 g | C. | 26.5g | D. | 58.5g |
5.下列过程有热量放出的是( )
| A. | 醋酸的电离 | B. | Ba(OH)2•8H2O晶体与NH4Cl晶体反应 | ||
| C. | 焦炭与二氧化碳气体发生的反应 | D. | Na与H2O反应 |
12.下列除杂试剂(括号内为杂质)选择正确的是( )
| A. | CO2(SO2):澄清石灰水 | B. | CO2(CO):通入氧气,并加热 | ||
| C. | Cl2(HCl):饱和碳酸钠溶液 | D. | Fe(Al):烧碱溶液 |
2.有相同质量的两份NaHCO3粉末,第一份加入足量盐酸,第二份先加热使其完全分解再加足量同质量分数的盐酸,则两者所消耗的盐酸中氯化氢的质量比为( )
| A. | 2:1 | B. | 1:1 | C. | 1:2 | D. | 4:2 |
9.下列各物质的中心原子采用sp3杂化的是( )
| A. | NH3 | B. | O3 | C. | CO2 | D. | BeCl2 |
6.某工厂的电镀污泥中含有铜、铁等金属化合物.为实现资源的回收利用并有效防止环境污染,设计如下工艺流程:
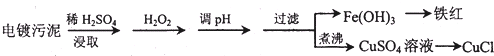
(1)酸浸后加入H2O2的目的是将Fe2+氧化成Fe3+,便于调整pH值与Cu2+分离.调pH步骤中加入的试剂最好是CuO、或Cu(OH)2、或CuCO3(填化学式).实验室进行过滤操作所用到的玻璃仪器有漏斗、烧杯、玻璃棒.
(2)向CuSO4溶液中加入一定量的NaCl、Na2SO3,可以生成白色的CuCl沉淀,写出该反应的化学方程式2CuSO4+2NaCl+Na2SO3+H2O=2CuCl↓+2Na2SO4+H2SO4.
(3)CuCl产品中CuCl的质量分数大于96.50%为国家合格标准.称取所制备的CuCl样品0.2500g置于一定量的0.5mol/LFeCl3溶液中,待样品完全溶解后,加水20mL,用0.1000mol/L的Ce(SO4)2溶液滴定,到达滴定终点时消耗Ce(SO4)2溶液24.60mL.有关的化学反应为:Fe3++CuCl═Fe2++Cu2++Cl-,Ce4++Fe2+═Fe3++Ce3+,通过计算说明该CuCl样品符合(填“符合”或“不符合”)国家标准.
(4)25℃时,Ksp[Fe(OH]3]=4.0×10-38.Fe3+发生水解反应Fe3++3H2O?Fe(OH)3+3H+,该反应的平衡常数为2.5×10-5.

| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀的pH | 2.3 | 7.6 | 4.4 |
| 完全沉淀的pH | 3.2 | 9.7 | 6.4 |
(2)向CuSO4溶液中加入一定量的NaCl、Na2SO3,可以生成白色的CuCl沉淀,写出该反应的化学方程式2CuSO4+2NaCl+Na2SO3+H2O=2CuCl↓+2Na2SO4+H2SO4.
(3)CuCl产品中CuCl的质量分数大于96.50%为国家合格标准.称取所制备的CuCl样品0.2500g置于一定量的0.5mol/LFeCl3溶液中,待样品完全溶解后,加水20mL,用0.1000mol/L的Ce(SO4)2溶液滴定,到达滴定终点时消耗Ce(SO4)2溶液24.60mL.有关的化学反应为:Fe3++CuCl═Fe2++Cu2++Cl-,Ce4++Fe2+═Fe3++Ce3+,通过计算说明该CuCl样品符合(填“符合”或“不符合”)国家标准.
(4)25℃时,Ksp[Fe(OH]3]=4.0×10-38.Fe3+发生水解反应Fe3++3H2O?Fe(OH)3+3H+,该反应的平衡常数为2.5×10-5.
7.根据氢原子和氟原子的核外电子排布,对F2和HF分子中形成的共价键描述正确的是( )
| A. | 两者都为s-s σ 键 | B. | 两者都为p-p σ 键 | ||
| C. | 前者为p-p σ 键,后者为s-p σ 键 | D. | 前者为s-s σ 键,后者为s-p σ 键 |