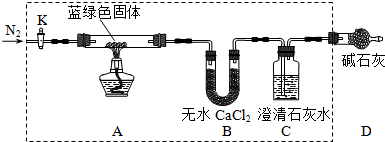
题目内容
7.下列大小比较不正确的是( )| A. | 熔沸点:SiO2>NaCl>S>CO2 | B. | 酸性:HNO2<HNO3;H3PO4<H2SO4 | ||
| C. | 还原性:H2S>HI>HBr>HCl | D. | 键长:C-H<N-H<O-H |
分析 A、熔点一般为原子晶体>离子晶体>金属晶体>分子晶体;
B、HNO2是弱酸,而HNO3是强酸;元素的非金属性越强,最高价含氧酸的酸性越强;
C、元素的非金属性越强,则单质的氧化性越强,对应阴离子的还原性越弱;
D、键长指成键原子的核间距,原子半径越大,键长越长.
解答 解:A、熔点一般为原子晶体>离子晶体>金属晶体>分子晶体,SiO2为原子晶体,NaCl为离子晶体,S和CO2均为分子晶体,标况下硫为固体,二氧化碳为气体,故熔沸点:SiO2>NaCl>S>CO2,故A正确;
B、HNO2是弱酸,HNO3是强酸,故酸性:HNO2<HNO3;H3PO4是中强酸,H2SO4是强酸,故酸性:H3PO4<H2SO4,故B正确;
C.非金属性:S<I<Br<Cl,故还原性:H2S>HI>HBr>HCl,故C正确;
D.同一周期,从左往右,原子半径逐渐减小,故原子半径:C>N>O,故键长:C-H>N-H>O-H,故D错误.
故选D.
点评 本题考查元素周期律知识,难度不大.侧重于学生的分析能力和基本概念的理解和运用的考查.

练习册系列答案
相关题目
16.下述实验能达到预期目的是( )
| A. | 将SO2通入酸性KMnO4 溶液中,紫色褪去 证明SO2具有漂白性 | |
| B. | 在滴有酚酞的Na2CO3溶液中,加入CaCl2溶液后红色褪去 证明Na2CO3溶液中存在水解平衡 | |
| C. | 向1mL0.2mol/L NaOH溶液中滴入2滴0.1mol/L的MgCl2溶液产生白色沉淀后,再滴加2滴0.1mol/L的FeCl3溶液,又生成红褐色沉淀 证明在相同温度下,氢氧化镁的溶解度大于氢氧化铁的溶解度 | |
| D. | 测定等物质的量浓度的HCl与H2S溶液的pH,后者较大 证明非金属性Cl>S |
17.下列反应属于吸热反应的是( )
| A. | 钠与水反应 | B. | 碳与二氧化碳高温反应 | ||
| C. | 盐酸与氢氧化钠溶液反应 | D. | 甲烷在空气中燃烧 |
12.用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 标准状况下,22.4L水含有NA个水分子 | |
| B. | 氧气和臭氧的混合物32 g中含有NA个氧原子 | |
| C. | 0.1mol Na2O2与水反应时转移0.1NA个电子 | |
| D. | 11.2 L氯气中含有NA个氯原子 |
16.“绿色奥运”是2008北京奥运会的主题之一.为减轻污染,北京为汽车加装了“三效催化净化器”,可将尾气中的一氧化碳、一氧化氮转化为参与大气循环的无毒混合气体,该无毒混合气体是( )
| A. | 二氧化碳和氮气 | B. | 二氧化碳和二氧化氮 | ||
| C. | 二氧化碳和氧气 | D. | 氮气和氧气 |
17.下列有关研究化学反应原理的叙述中,正确的是( )
| A. | 研究化学反应中的能量变化,有利于通过改变反应条件,使同一反应消耗相同量的物质而放出更多的热,提高化学能的利用率 | |
| B. | 任何放热的化学反应,均可以利用原电池直接把化学能转化为电能 | |
| C. | 研究化学反应速率与化学平衡,有利于指导实际生产中达到“多,快,好,省”的生产效率 | |
| D. | 使用催化剂常常可以加快化学反应速率,但不能提高反应物的转化率,因此在实际生产中较少使用催化剂 |
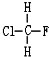 与
与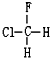 B.
B. 与
与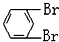 C.
C.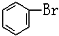 与
与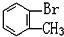 D.
D.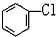 与
与 E.ClC(CH3)3与(CH3)2CHCH2Cl F.
E.ClC(CH3)3与(CH3)2CHCH2Cl F.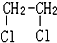 与CH3-CH2Cl
与CH3-CH2Cl 由一种单体脱水缩聚而成的,该单体的键线式为
由一种单体脱水缩聚而成的,该单体的键线式为
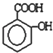 )滴入Na2CO3溶液中,生成的有机物的结构简式是:
)滴入Na2CO3溶液中,生成的有机物的结构简式是: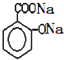
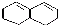 在较高温度下和Br2按物质的量之比1:1发生1,4-加成反应的化学方程式
在较高温度下和Br2按物质的量之比1:1发生1,4-加成反应的化学方程式 .
.