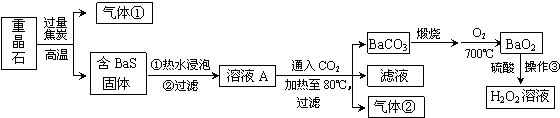
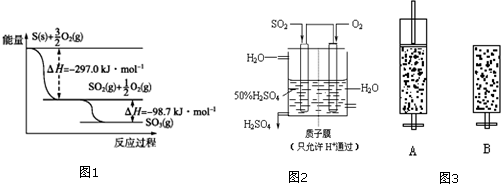
题目内容
12.下列说法正确的是( )| A. | 苯在一定条件下可以和H2反应 | B. | 甲烷和乙醇都属于饱和烃 | ||
| C. | 一氯甲烷分子式为CH4Cl | D. | 乙烷和乙烯是同系物 |
分析 A.苯环可发生加成反应;
B.乙醇含O元素;
C.甲烷中1个H被Cl原子取代后的产物为一氯甲烷;
D.乙烷为饱和烃,乙烯为不饱和烃.
解答 解:A.苯环可发生加成反应,则苯在一定条件下可以和H2反应生成环己烷,故A正确;
B.乙醇含O元素,为烃的衍生物,而甲烷属于烃,故B错误;
C.甲烷中1个H被Cl原子取代后的产物为一氯甲烷,则一氯甲烷分子式为CH3Cl,故C错误;
D.乙烷为饱和烃,乙烯为不饱和烃,二者结构不相似,不是同系物,故D错误;
故选A.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质、有机反应、有机物的组成为解答的关键,侧重分析与应用能力的考查,注意同系物的判断,题目难度不大.

练习册系列答案
 特高级教师点拨系列答案
特高级教师点拨系列答案
相关题目
3.在复杂的体系中,确认化学反应先后顺序有利于解决问题.下列化学反应先后顺序判断正确的是( )
| A. | 在含有等物质的量的AlO2-、OH-、CO32-溶液中,逐滴加入盐酸:AlO2-、OH-、CO32- | |
| B. | 在含等物质的量的FeBr2、FeI2溶液中,缓慢通入氯气:I-、Br-、Fe2+ | |
| C. | 在含等物质的量的KOH、Ba(OH)2溶液中,缓慢通入CO2:KOH、Ba(OH)2、K2CO3、BaCO3 | |
| D. | 在含等物质的量的Fe3+、Cu2+、H+溶液中加入锌粉:Fe3+、Cu2+、H+ |
20.下列物质中,属于共价化合物的是( )
| A. | NH4Cl | B. | H2O2 | C. | NaCl | D. | I2 |
7.在含有大量Ba2+、H+、NO${\;}_{3}^{-}$的溶液中,还可能大量共存的离子是( )
| A. | Fe2+ | B. | NH${\;}_{4}^{+}$ | C. | HCO${\;}_{3}^{-}$ | D. | OH- |
17.日常生活和工业生产中常用到漂白剂.下列物质具有漂白作用的有( )
| A. | NaClO溶液 | B. | 新制氯水 | C. | 二氧化硫 | D. | 稀H2SO4 |
1.下列物质分子中,各原子不处于同一平面的是:①甲苯;②乙炔;③乙烯;④乙烷;⑤甲烷;⑥苯;⑦丙烯.( )
| A. | ②③⑦ | B. | ①④⑥ | C. | ②③⑥ | D. | ①④⑤⑦ |