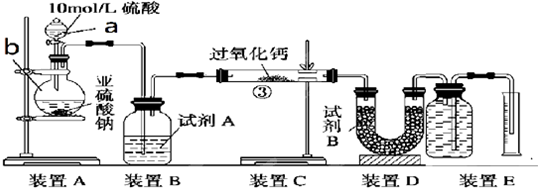
题目内容
已知25℃时有关物质的电离平衡常数
下列叙述错误的是( )
| 化学式 | CH3COOH | HClO | H2CO3 |
| 电离平衡常数 | 1.75×10-5 | 3.0×10-8 | K1=4.4×10-7 K2=4.7×10-11 |
| A、等物质的量浓度的各溶液pH关系为:pH(NaClO)>pH(Na2CO3)>pH(NaHCO3)>pH(CH3COONa) |
| B、向NaClO溶液中通入少量CO2气体反应为:ClO-+H2O+CO2=HClO+HCO3- |
| C、等物质的量浓度的HClO稀溶液与NaOH稀溶液等体积混合后溶液中:c(Na+)>c(ClO-)>c(OH-)>c(H+) |
| D、Na2CO3和NaHCO3混合液中,一定有:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-) |
考点:弱电解质在水溶液中的电离平衡
专题:
分析:A、酸的电离平衡常数越大,酸电离程度越大,则酸根离子水解程度越小,相同浓度的钠盐溶液的pH越小;
B、NaClO和少量碳酸反应生成次氯酸和碳酸氢钠;
C、等物质的量浓度的苯次氯酸稀溶液与NaOH稀溶液等体积混合,二者恰好反应生成次氯酸钠,次氯酸钠中次氯酸根离子水解导致溶液呈碱性,再结合电荷守恒判断;
D、任何电解质溶液中都存在电荷守恒,根据电荷守恒判断.
B、NaClO和少量碳酸反应生成次氯酸和碳酸氢钠;
C、等物质的量浓度的苯次氯酸稀溶液与NaOH稀溶液等体积混合,二者恰好反应生成次氯酸钠,次氯酸钠中次氯酸根离子水解导致溶液呈碱性,再结合电荷守恒判断;
D、任何电解质溶液中都存在电荷守恒,根据电荷守恒判断.
解答:
解:A、酸的电离平衡常数越大,酸电离程度越大,则酸根离子水解程度越小,相同浓度的钠盐溶液的pH越小,根据电离平衡常数知,酸根离子水解程度大小顺序是 CO32->ClO->HCO3->CH3COO-,所以相同浓度的钠盐溶液pH大小顺序是pH(Na2CO3)>pH(NaClO)>pH(NaHCO3)>pH(CH3COONa),故A错误;
B、次氯酸钠和少量碳酸反应生成次氯酸钠和碳酸氢钠,离子方程式为ClO-+H2O+CO2→HClO+HCO3-,故B正确;
C、等物质的量浓度的次氯酸稀溶液与NaOH稀溶液等体积混合,二者恰好反应生成次氯酸钠,次氯酸钠中次氯酸根离子水解导致溶液呈碱性,则c(OH-)>c(H+),再结合电荷守恒得c(Na+)>c(ClO-),酸根离子水解程度较小,所以离子浓度大小顺序是c(Na+)>c(ClO-)>c(OH-)>c(H+),故C正确;
D、任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-),故D错误;
故选AD.
B、次氯酸钠和少量碳酸反应生成次氯酸钠和碳酸氢钠,离子方程式为ClO-+H2O+CO2→HClO+HCO3-,故B正确;
C、等物质的量浓度的次氯酸稀溶液与NaOH稀溶液等体积混合,二者恰好反应生成次氯酸钠,次氯酸钠中次氯酸根离子水解导致溶液呈碱性,则c(OH-)>c(H+),再结合电荷守恒得c(Na+)>c(ClO-),酸根离子水解程度较小,所以离子浓度大小顺序是c(Na+)>c(ClO-)>c(OH-)>c(H+),故C正确;
D、任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-),故D错误;
故选AD.
点评:本题以弱酸的电离为载体考查了离子浓度大小比较,明确酸的电离平衡常数与酸根离子水解程度的关系是解本题关键,再结合电荷守恒来分析解答,注意碳酸根离子和苯酚根离子的相对大小,注意B中无论二氧化碳是否过量都生成碳酸氢钠,为易错点.

练习册系列答案
相关题目
下列解释事实的化学方程式或离子方程式正确的是( )
| A、用食醋除去暖水瓶中的水垢:2CH3COOH+CaCO3═Ca2++2CH3COO-+CO2↑+H2O |
| B、碳酸氢铵溶液中加入足量氢氧化钡溶液:NH4++HCO3-+2OH-═CO32-+NH3?H2O+H2O |
| C、Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-═2Fe2++I2 |
| D、Ca(HCO3)2溶液中加入少量的NaOH溶液:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O |
A、B、C为三种短周期元素,A、B在同一周期,A、C的最低价离子分别为A2-、C-,离子半径A2-大于C-,B2+和C-具有相同的电子层结构.下列判断正确的是( )
| A、原子序数由大到小的顺序是C>A>B |
| B、原子半径由大到小的顺序是r(B)>r(A)>r(C) |
| C、离子半径由大到小的顺序是r(C-)>r(B2+)>r(A2-) |
| D、原子最外层电子数由多到少的顺序是B>A>C |
某同学用量筒量取液体时,将量筒平放,仰视液体凹液面最低处读数为16.0mL,倾倒出一部分溶液,又俯视液体凹液面最低处,读数为10.0mL,该同学取出液体的体积是( )
| A、大于6.0mL |
| B、等于6.0mL |
| C、小于6.0mL |
| D、无法判断 |
不能用来判断醋酸属于弱电解质的实验事实是( )
| A、向某浓度的醋酸钠溶液滴入几滴酚酞试液:溶液由无色变为浅红色 |
| B、向滴有甲基橙试液的醋酸溶液加入少量醋酸钠晶体:振荡后溶液由红色变为橙色 |
| C、通过对比不同浓度的导电实验:醋酸溶液的导电性较盐酸溶液的导电性弱 |
| D、取相同体积pH=1的盐酸和醋酸溶液,分别加入足量的锌,用排水法收集生成的氢气:相同条件下,醋酸生成的氢气体积大 |
使相同体积的NaCl、CaCl2、AlCl3溶液中的Cl-全部沉淀,用去同浓度的AgNO3溶液的体积分别为3V、2V、V,则NaCl、CaCl2、AlCl3溶液的物质的量浓度之比为( )
| A、6:3:2 |
| B、3:2:1 |
| C、9:3:1 |
| D、1:2:3 |