题目内容
某同学用量筒量取液体时,将量筒平放,仰视液体凹液面最低处读数为16.0mL,倾倒出一部分溶液,又俯视液体凹液面最低处,读数为10.0mL,该同学取出液体的体积是( )
| A、大于6.0mL |
| B、等于6.0mL |
| C、小于6.0mL |
| D、无法判断 |
考点:计量仪器及使用方法
专题:化学实验基本操作
分析:用量筒量取液体时,量筒要放平,读数时视线应与凹液面最低处相平;如果仰视液面,读数比实际偏小,若俯视液面,读数比实际偏大.根据量筒的读数与实际值的关系来判断该学生实际倒出液体的体积大小.
解答:
解:仰视液体凹液面最低处,读数为16mL,实际量取液体的体积偏大,可以假设为17mL,又俯视液体凹液面最低处,读数为10mL,实际量取液体的体积偏小,可以假设为10mL,所以倒出液体的体积为:17mL-10mL=7mL,大于6mL.
故选A.
故选A.
点评:本题考查量筒的错误操作造成的误差的分析方法,侧重于常识性内容的考查,难度不大,注意基础知识的积累.

练习册系列答案
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案
相关题目
下列叙述正确的是( )
| A、直径介于1~10nm之间的微粒称为胶体 |
| B、NaOH溶液中滴加FeCl3溶液制得Fe(OH)3胶体 |
| C、利用丁达尔效应可以区别溶液与胶体 |
| D、过滤可以分离胶体粒子与溶液中的溶质粒子 |
已知25℃时有关物质的电离平衡常数
下列叙述错误的是( )
| 化学式 | CH3COOH | HClO | H2CO3 |
| 电离平衡常数 | 1.75×10-5 | 3.0×10-8 | K1=4.4×10-7 K2=4.7×10-11 |
| A、等物质的量浓度的各溶液pH关系为:pH(NaClO)>pH(Na2CO3)>pH(NaHCO3)>pH(CH3COONa) |
| B、向NaClO溶液中通入少量CO2气体反应为:ClO-+H2O+CO2=HClO+HCO3- |
| C、等物质的量浓度的HClO稀溶液与NaOH稀溶液等体积混合后溶液中:c(Na+)>c(ClO-)>c(OH-)>c(H+) |
| D、Na2CO3和NaHCO3混合液中,一定有:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-) |
用NaOH溶液滴定盐酸时,由于滴定速率太快,当混合溶液变红时,不知NaOH是否过量,判断它是否过量的方法是( )
| A、加入5mL盐酸进行滴定 |
| B、返滴一滴待测盐酸 |
| C、重新进行滴定 |
| D、以上方法均不适用 |
 某学校化学科研小组从文献资料上获得如下信息:NaHCO3在潮湿的空气中会缓慢分解成Na2CO3、H2O和CO2.为了验证这一信息,该科研小组将一瓶在潮湿空气中久置的NaHCO3样品混合均匀后,进行如下实验:
某学校化学科研小组从文献资料上获得如下信息:NaHCO3在潮湿的空气中会缓慢分解成Na2CO3、H2O和CO2.为了验证这一信息,该科研小组将一瓶在潮湿空气中久置的NaHCO3样品混合均匀后,进行如下实验: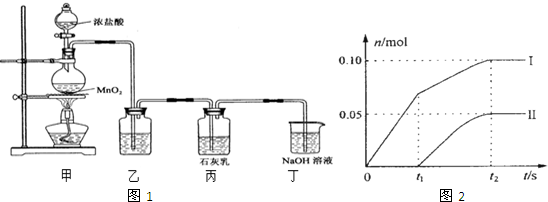
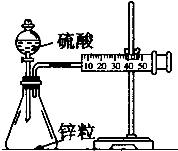 I.某校化学学习小组为了探究草酸(H2C2O4)的化学性质,设计了如下实验:
I.某校化学学习小组为了探究草酸(H2C2O4)的化学性质,设计了如下实验: