题目内容
不能用来判断醋酸属于弱电解质的实验事实是( )
| A、向某浓度的醋酸钠溶液滴入几滴酚酞试液:溶液由无色变为浅红色 |
| B、向滴有甲基橙试液的醋酸溶液加入少量醋酸钠晶体:振荡后溶液由红色变为橙色 |
| C、通过对比不同浓度的导电实验:醋酸溶液的导电性较盐酸溶液的导电性弱 |
| D、取相同体积pH=1的盐酸和醋酸溶液,分别加入足量的锌,用排水法收集生成的氢气:相同条件下,醋酸生成的氢气体积大 |
考点:弱电解质在水溶液中的电离平衡
专题:
分析:A、溶液由无色变为浅红色,说明醋酸钠溶液呈碱性,醋酸钠是强碱弱酸盐;
B、滴入甲基橙试液,显红色,再加入醋酸钠晶体,颜色变橙色,说明醋酸钠的加入引起了溶液中c(H+)变化,只有弱电解质才存在电离平衡;
C、导电能力的强弱与电解质的强弱无关;
D、相同温度下,pH相同、体积相同的盐酸和醋酸溶液分别与足量的锌粒反应,因醋酸是弱酸能电离出更多的氢离子,所以生成的氢气较多.
B、滴入甲基橙试液,显红色,再加入醋酸钠晶体,颜色变橙色,说明醋酸钠的加入引起了溶液中c(H+)变化,只有弱电解质才存在电离平衡;
C、导电能力的强弱与电解质的强弱无关;
D、相同温度下,pH相同、体积相同的盐酸和醋酸溶液分别与足量的锌粒反应,因醋酸是弱酸能电离出更多的氢离子,所以生成的氢气较多.
解答:
解:A、溶液由无色变为浅红色,说明醋酸钠溶液呈碱性,醋酸钠是强碱弱酸盐,故A正确;
B、滴入甲基橙试液,显红色,再加入醋酸钠晶体,颜色变橙色,说明醋酸钠的加入引起了溶液中c(H+)变化,只有弱电解质才存在电离平衡,所以可以证明醋酸是弱电解质,故B正确;
C、导电能力的强弱与电解质的强弱无关,故C错误;
D、相同温度下,pH相同、体积相同的盐酸和醋酸溶液,二者都是一元酸,已经电离的n(H+)是相等的,但随着H2的不断生成,醋酸还能继续电离出H+,而盐酸不会增加H+,故当锌足量时,醋酸产生的H2肯定多,故D正确;
故选:C.
B、滴入甲基橙试液,显红色,再加入醋酸钠晶体,颜色变橙色,说明醋酸钠的加入引起了溶液中c(H+)变化,只有弱电解质才存在电离平衡,所以可以证明醋酸是弱电解质,故B正确;
C、导电能力的强弱与电解质的强弱无关,故C错误;
D、相同温度下,pH相同、体积相同的盐酸和醋酸溶液,二者都是一元酸,已经电离的n(H+)是相等的,但随着H2的不断生成,醋酸还能继续电离出H+,而盐酸不会增加H+,故当锌足量时,醋酸产生的H2肯定多,故D正确;
故选:C.
点评:本题考查了弱电解质的判断,电解质强弱是根据其电离程度划分的,不能根据溶液导电性强弱划分,为易错点.

练习册系列答案
相关题目
已知:将Cl2通入适量KOH溶液,产物中可能有KC1、KClO、KC1O3,且
的值与温度高低有关.当n(KOH)=amol时,下列有关说法错误的是( )
| c(Cl-) |
| c(ClO-) |
A、若某温度下,反应后C(Cl-):C(ClO-)=11,则溶液中C(ClO-):C(ClO3-)=
| ||||
B、参加反应的氯气的物质的量等于
| ||||
C、改变温度,反应中转移电子的物质的量n的范围:
| ||||
D、改变温度,产物中KC1O3的最大理论产量为
|
已知25℃时有关物质的电离平衡常数
下列叙述错误的是( )
| 化学式 | CH3COOH | HClO | H2CO3 |
| 电离平衡常数 | 1.75×10-5 | 3.0×10-8 | K1=4.4×10-7 K2=4.7×10-11 |
| A、等物质的量浓度的各溶液pH关系为:pH(NaClO)>pH(Na2CO3)>pH(NaHCO3)>pH(CH3COONa) |
| B、向NaClO溶液中通入少量CO2气体反应为:ClO-+H2O+CO2=HClO+HCO3- |
| C、等物质的量浓度的HClO稀溶液与NaOH稀溶液等体积混合后溶液中:c(Na+)>c(ClO-)>c(OH-)>c(H+) |
| D、Na2CO3和NaHCO3混合液中,一定有:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-) |
用NaOH溶液滴定盐酸时,由于滴定速率太快,当混合溶液变红时,不知NaOH是否过量,判断它是否过量的方法是( )
| A、加入5mL盐酸进行滴定 |
| B、返滴一滴待测盐酸 |
| C、重新进行滴定 |
| D、以上方法均不适用 |
利用下列实验方案可以从海洋动物柄海鞘中提取具有抗肿瘤作用的活性物质.下列说法错误的是( )
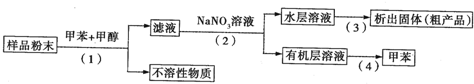

| A、步骤(1)需要过滤装置 |
| B、活性物质易溶于有机溶剂,难溶于水 |
| C、步骤(3)需要用到蒸发皿 |
| D、步骤(4)是利用物质的沸点差异进行分离的 |
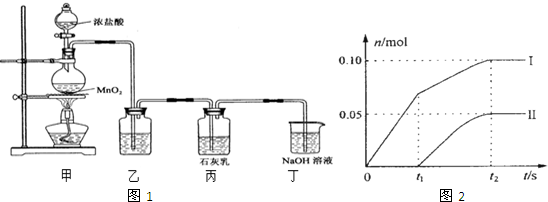
 某学生用0.1000mol?L-1标准NaOH溶液滴定未知浓度的盐酸,其操作可分解为以下几步:
某学生用0.1000mol?L-1标准NaOH溶液滴定未知浓度的盐酸,其操作可分解为以下几步: