题目内容
19.下列说法不正确的是( )| A. | Mg(OH)2固体在溶液中存在平衡:Mg(OH)2(s)?Mg2+(aq)+2OH-(aq),该固体可溶于NH4Cl溶液 | |
| B. | 向ZnS沉淀上滴加CuSO4溶液沉淀变为黑色,可推知同温下Ksp(ZnS)<Ksp(CuS) | |
| C. | 向AgCl悬浊液中滴加Na2S溶液,白色沉淀变成黑色,反应方程式为2AgCl(s)+S2-(aq)?Ag2S(s)+2Cl-(aq) | |
| D. | 向2mL浓度均为1.2mol•L-1的KCl、KI混合溶液中滴加1~2滴0.01mol•L-1的AgNO3溶液,振荡沉淀呈黄色,说明Ksp(AgCl)>Ksp(AgI) |
分析 A.氯化铵促进Mg(OH)2溶解平衡正向移动;
B.向ZnS沉淀上滴加CuSO4溶液沉淀变为黑色,发生沉淀的转化;
C.向AgCl悬浊液中滴加Na2S溶液,白色沉淀变成黑色,发生沉淀的转化;
D.振荡沉淀呈黄色,生成AgI沉淀,Ksp小的先沉淀.
解答 解:A.氯化铵与Mg(OH)2(s)?Mg2+(aq)+2OH-(aq)产生的氢氧根离子反应,促进Mg(OH)2溶解平衡正向移动,则固体可溶于NH4Cl溶液,故A正确;
B.向ZnS沉淀上滴加CuSO4溶液沉淀变为黑色,发生沉淀的转化,则同温下Ksp(ZnS)>Ksp(CuS),故B错误;
C.向AgCl悬浊液中滴加Na2S溶液,白色沉淀变成黑色,发生沉淀的转化,则反应方程式为2AgCl(s)+S2-(aq)?Ag2S(s)+2Cl-(aq),故C正确;
D.振荡沉淀呈黄色,生成AgI沉淀,Ksp小的先沉淀,则说明Ksp(AgCl)>Ksp(AgI),故D正确;
故选B.
点评 本题考查难溶电解质的溶解平衡,为高频考点,把握溶解平衡移动、沉淀的转化为解答本题的关键,侧重分析与应用能力的考查,注意选项A为解答的易错点,题目难度不大.

练习册系列答案
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案
相关题目
7.将下列物质分别加到湿的红色布条上,不能使其褪色是( )
| A. | 新制氯水 | B. | 液氯 | ||
| C. | 次氯酸钠溶液和HCl混合液 | D. | 氯化钙 |
14.在密闭容器中,可逆反应N2+3H2?2NH3达到平衡后,若保持温度不变,缩小容器体积,达到新平衡时,下列说法正确的是( )
①NH3的浓度增大,N2和H2的浓度减小②NH3的物质的量增大,N2和H2的物质的量减小③H2的转化率增大,N2的转化率不变④混合气体的平均分子量增大.
①NH3的浓度增大,N2和H2的浓度减小②NH3的物质的量增大,N2和H2的物质的量减小③H2的转化率增大,N2的转化率不变④混合气体的平均分子量增大.
| A. | ①④ | B. | ②④ | C. | ①② | D. | ③④ |
4.表中括号内物质是杂质,试将除杂试剂及分离方法填入表内:
| 混合物 | SiO2 (Si) | CO2(SO2) | NaHCO3(Na2SiO3) | SiO2(NaCl) |
| 除杂试剂 | 空气 | 饱和碳酸氢钠溶液 | 水、足量二氧化碳 | 水 |
| 除杂方法 | 加热 | 洗气 | 过滤、蒸发 | 过滤 |
11.已知1gH2完全燃烧生成水蒸气放出热量为121kJ,有关数据如下:O=O(键能为496kJ•mol-1)、H-H(键能为436kJ•mol-1),试求H2O(g)中H-O键的键能为( )
| A. | 463kJ•mol-1 | B. | 926kJ•mol-1 | C. | 1852kJ•mol-1 | D. | 920kJ•mol-1 |
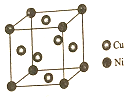 东晋《华阳国志南中志》卷四种已有关于白铜的记载,云南镍白铜(铜镍合金)文明中外,曾主要用于造币,亦可用于制作仿银饰品.回答下列问题:
东晋《华阳国志南中志》卷四种已有关于白铜的记载,云南镍白铜(铜镍合金)文明中外,曾主要用于造币,亦可用于制作仿银饰品.回答下列问题: (X为卤素原子)
(X为卤素原子) 的物质,该物质是一种香料.
的物质,该物质是一种香料. $→_{催化剂}^{①CH_{2}=CH-CH_{3}}$A$→_{一氯代物}^{②光照}$B$\stackrel{③}{→}$C$→_{HCl}^{④}$D$\stackrel{⑤}{→}$E$\stackrel{⑥氧化反应}{→}$
$→_{催化剂}^{①CH_{2}=CH-CH_{3}}$A$→_{一氯代物}^{②光照}$B$\stackrel{③}{→}$C$→_{HCl}^{④}$D$\stackrel{⑤}{→}$E$\stackrel{⑥氧化反应}{→}$
 .
. 、2
、2 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2 、
、 、
、 .
.