题目内容
4.下列说法中正确的是( )| A. | 足量的CO2和水蒸气的混合气体与少量的Na2O2充分反应,最终必生成NaOH | |
| B. | 足量的MnO2与含4molHCl的浓盐酸加热充分反应,产生的Cl2必为1mol | |
| C. | 含2molHCl的某盐酸滴入足量的碳酸钠溶液中充分反应后,得到CO2气体必为1mol | |
| D. | 过量的二氧化碳通入偏铝酸钠溶液中,最终生成的产物必为Al(OH)2和碳酸氢钠 |
分析 A、足量的CO2和水蒸气的混合气体与少量的Na2O2充分反应,首先与二氧化碳气体反应;
B、随反应的进行浓盐酸变稀盐酸,稀盐酸与二氧化锰不反应;
C、少量盐酸滴入碳酸钠生成碳酸氢钠;
D、碳酸的酸性强于氢氧化铝,而二氧化碳足量与碳酸钠反应.
解答 解:A、足量的CO2和水蒸气的混合气体与少量的Na2O2充分反应,首先与二氧化碳气体反应,所以足量的CO2和水蒸气的混合气体与少量的Na2O2充分反应,最终必生成碳酸钠,故A错误;
B、随反应的进行浓盐酸变稀盐酸,稀盐酸与二氧化锰不反应,所以参加反应的盐酸小于4mol,生成氯气小于1mol,故B错误;
C、少量盐酸滴入碳酸钠生成碳酸氢钠,所以最后得不到气体,故C错误;
D、碳酸的酸性强于氢氧化铝的酸性,而足量的二氧化碳与碳酸钠反应生成碳酸氢钠,所以过量的二氧化碳通入偏铝酸钠溶液中,最终生成的产物必为Al(OH)2和碳酸氢钠,故D正确;
故选D.
点评 本题综合考查钠的化合物知识,为高考常见题型和高频考点,侧重于学生的分析能力和元素化合物知识的综合理解和运用的考查,注意相关基础知识的积累,难度不大.

练习册系列答案
 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案
相关题目
14.在密闭容器中,可逆反应N2+3H2?2NH3达到平衡后,若保持温度不变,缩小容器体积,达到新平衡时,下列说法正确的是( )
①NH3的浓度增大,N2和H2的浓度减小②NH3的物质的量增大,N2和H2的物质的量减小③H2的转化率增大,N2的转化率不变④混合气体的平均分子量增大.
①NH3的浓度增大,N2和H2的浓度减小②NH3的物质的量增大,N2和H2的物质的量减小③H2的转化率增大,N2的转化率不变④混合气体的平均分子量增大.
| A. | ①④ | B. | ②④ | C. | ①② | D. | ③④ |
15.有关电化学知识的描述正确的是( )
| A. | CaO+H2O═Ca(OH)2,可以放出大量的热,故可把该反应设计成原电池,把其中的化学能转化为电能 | |
| B. | 其他条件均相同,带有“盐桥”的原电池比不带“盐桥”的原电池电流持续时间长 | |
| C. | 原电池工作时,正极表面一定有气泡产生 | |
| D. | 钢铁水闸可用牺牲阴极或外加电流的阳极保护法防止其腐蚀 |
19.除去下列物质中的杂质(括号内是杂质),能采用加入过量NaOH溶液再过滤的是( )
| A. | SiO2(CaCO3) | B. | KCl(NaCl) | C. | Fe2O3(Al2O3) | D. | FeCl2溶液(FeCl3) |
7.随着社会的发展,人们日益重视环境问题,下列做法或说法不正确的是( )
| A. | 对农作物秸秆进行焚烧还田,以增加土壤肥力 | |
| B. | 推广使用无磷洗衣粉,以减少水体富营养化 | |
| C. | 改进汽车尾气净化技术,减少大气污染物的排放 | |
| D. | 研发可降解高分子材料,减少“白色污染” |
8.在标准状况下,气态分子断开1mol化学键的焓称为键焓.已知几种化学键的键焓如下表所示:
下列说法正确的是( )
| 化学键 | C-C | C═C | C≡C | C-H | H-H | Cl-Cl | H-Cl |
| 键焓(△H)/kJ•mol-1 | 347.7 | 615.0 | 812.0 | 413.4 | 436.0 | 242.7 | 431 |
| A. | CH2═CH2(g)+H2(g)→CH3CH3(g)△H=+123.5 kJ•mol-1 | |
| B. | CH≡CH(g)+2H2(g)→CH3CH3(g)△H=-317.3 kJ•mol-1 | |
| C. | 稳定性:H-H键<H-Cl键<C-H键 | |
| D. | 由上表数据可计算乙烷与氯气发生一氯代反应的焓变(△H) |
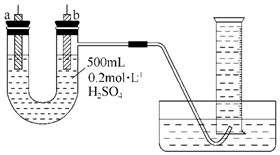 给你提供纯锌、纯铜片和500mL 0.2mol•L-1的H2SO4溶液、导线、1 000mL量筒.试用如图装置来测定锌和稀硫酸反应时在某段时间内通过导线的电子的物质的量.
给你提供纯锌、纯铜片和500mL 0.2mol•L-1的H2SO4溶液、导线、1 000mL量筒.试用如图装置来测定锌和稀硫酸反应时在某段时间内通过导线的电子的物质的量.