题目内容
1.下列方法中,可制得Cl2的正确组合是( )①MnO2和浓盐酸混合共热 ②KMnO4和浓盐酸混合 ③NaClO和浓盐酸混合
④K2Cr2O7和浓盐酸混合 ⑤KClO3和浓盐酸混合.
| A. | ①② | B. | ②③④ | C. | ①④ | D. | ①②③④⑤ |
分析 ①二氧化锰在加热条件下可以氧化浓盐酸生成氯气;
②KMnO4具有强的氧化性,能够氧化浓盐酸得氯气;
③NaClO和氯化氢发生归中反应生成氯气;
④K2Cr2O7具有强的氧化性,能够氧化浓盐酸得氯气;
⑤KClO3具有强的氧化性,能够氧化浓盐酸得氯气.
解答 解:①二氧化锰在加热条件下可以氧化浓盐酸生成氯气,可以用①来制备氯气;
②KMnO4具有强的氧化性,能够氧化浓盐酸得氯气,可以用②来制备氯气;
③NaClO和氯化氢发生归中反应生成氯气,可以用③来制备氯气;
④K2Cr2O7具有强的氧化性,能够氧化浓盐酸得氯气,可以用④来制备氯气;
⑤KClO3具有强的氧化性,能够氧化浓盐酸得氯气,可以用⑤来制备氯气;
故选:D.
点评 本题以氯气的制备为载体考查了氯气的性质,题目综合性较强,侧重考查依据所学知识分析问题、解决问题的能力,难度中等.

练习册系列答案
相关题目
12.下列做法正确的是( )
| A. | 为了使火腿肠颜色更鲜红,可多加一些亚硝酸钠 | |
| B. | 为了使婴儿对食品有浓厚兴趣,我们可以在婴儿食品中加少量着色剂 | |
| C. | 食盐加碘是防止人体缺碘而加的营养强化剂,能预防地方性甲状腺肿 | |
| D. | 味精能增加食品的鲜味,促进食欲,炒菜时应该多放一点 |
9.下列说法正确的是( )
| A. | 热化学方程式中,如没有注明温度和压强,表示反应热是在标准状况下测得的数据 | |
| B. | 物质发生化学变化不一定伴随着能量变化 | |
| C. | 发生碰撞的分子只要具有足够的能量,就能够发生有效碰撞 | |
| D. | 化学反应速率可通过实验测定,比如可以测量在一定温度和压强下释放出的气体的体积,或者可以用比色的方法测定溶液颜色的深浅进行换算 |
5.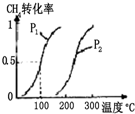 甲醇被称为21世纪的新型燃料,工业上用CH4和H2O为原料通过下列反应①和②,
甲醇被称为21世纪的新型燃料,工业上用CH4和H2O为原料通过下列反应①和②,
来制备甲醇.
①CH4(g)+H2O(g)?CO(g)+3H2(g)△H
②CO(g)+2H2(g)?CH3OH(g)△H△
将0.20mol CH4和0.30mol H2O(g)通入容积为10L的密闭容器中,在一定条件下发生反应①,达到平衡时,CH4的转化率与温度、压强的关系如图:
(1)温度不变,缩小体积,①的逆反应速率增大(填“增大”、“减小”或“不变”).
(2)反应①的△H>0(填“<”“=”或“>”);
100℃时的平衡常数值K=1.35×10-3.
(3)在压强为0.1Mpa条件下,将a molCO与3a molH2的混合气体在催化剂作用下进行反应②
再生成甲醇.为了发寻找合成甲醇的适宜的温度和压强,某同学设计了二组实验,部分实验条件已经填在下面实验设计表中.请在空格中填入剩余的实验条件数据.
300°C时,其他条件不变,将容器的容积压缩到原来的$\frac{1}{2}$,对平衡体系产生的影响是(填
字母)CD
A.c(H2)减少
B.正反应速率加快,逆反应速率减慢
C.CH3OH的物质的量增加D.重新平衡时c(H2)/c(CH2OH)减小
(4)已知在常温常压下:
①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△△H1=-1275.6kJ•mol-1
②2CO(g)+O2(g)═2CO2(g)△△H2=-556.0kJ•mol-1
③H2O(g)═H2O(l)△△H3=-44.0kJ•mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8kJ•mol-1.
(5)据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十倍,可连续使用一个月才充一次电.其电池
反应为:2CH3OH+3O2+4OH-?2CO32-+6H2O,放电时负极的电极反应方程为:CH3OH-6e-+8OH-=CO32-+6H2O.
 甲醇被称为21世纪的新型燃料,工业上用CH4和H2O为原料通过下列反应①和②,
甲醇被称为21世纪的新型燃料,工业上用CH4和H2O为原料通过下列反应①和②,来制备甲醇.
①CH4(g)+H2O(g)?CO(g)+3H2(g)△H
②CO(g)+2H2(g)?CH3OH(g)△H△
将0.20mol CH4和0.30mol H2O(g)通入容积为10L的密闭容器中,在一定条件下发生反应①,达到平衡时,CH4的转化率与温度、压强的关系如图:
(1)温度不变,缩小体积,①的逆反应速率增大(填“增大”、“减小”或“不变”).
(2)反应①的△H>0(填“<”“=”或“>”);
100℃时的平衡常数值K=1.35×10-3.
(3)在压强为0.1Mpa条件下,将a molCO与3a molH2的混合气体在催化剂作用下进行反应②
再生成甲醇.为了发寻找合成甲醇的适宜的温度和压强,某同学设计了二组实验,部分实验条件已经填在下面实验设计表中.请在空格中填入剩余的实验条件数据.
| 实验编号 | T(°C) | n(CO)/n(H2) | p(MPa) |
| Ⅰ | 150 | 1/3 | 0.1 |
| Ⅱ | 5 | ||
| Ⅲ | 350 | 5 |
字母)CD
A.c(H2)减少
B.正反应速率加快,逆反应速率减慢
C.CH3OH的物质的量增加D.重新平衡时c(H2)/c(CH2OH)减小
(4)已知在常温常压下:
①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△△H1=-1275.6kJ•mol-1
②2CO(g)+O2(g)═2CO2(g)△△H2=-556.0kJ•mol-1
③H2O(g)═H2O(l)△△H3=-44.0kJ•mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8kJ•mol-1.
(5)据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十倍,可连续使用一个月才充一次电.其电池
反应为:2CH3OH+3O2+4OH-?2CO32-+6H2O,放电时负极的电极反应方程为:CH3OH-6e-+8OH-=CO32-+6H2O.
9.碳及其化合物在工业生产中有广泛的用途.回答下列问题:
(1)C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ•mol-1,以上反应达到平衡后,在体积不变的条件下,以下措施有利于提高H2的产率的是AD;(填序号)
A.升高温度 B.增加碳的用量 C.加入催化剂 D.用CO吸收剂除去CO
(2)又知,C(s)+CO2(g)?2CO(g)△H=+172.5kJ•mol-1,则CO(g)+H2O(g)?CO2(g)+H2(g)的△H=-41.2kJ/mol;
(3)在一定温度下,将CO(g)和H2O(g)各0.16mol分别通入到体积为2.0L的恒容密闭容器中,发生以下反应:CO(g)+H2O(g)?CO2(g)+H2(g),得到如下数据:
①其他条件不变,降低温度,反应达到新平衡前v(逆)<v(正) (填“>”、“<”、“=”)
②该温度下此反应的平衡常数K=0.36;
③其他条件不变,再充入0.1mol CO和0.1mol H2O(g),平衡时CO的体积分数不变(填“增大”、“减小”、“不变”).
(1)C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ•mol-1,以上反应达到平衡后,在体积不变的条件下,以下措施有利于提高H2的产率的是AD;(填序号)
A.升高温度 B.增加碳的用量 C.加入催化剂 D.用CO吸收剂除去CO
(2)又知,C(s)+CO2(g)?2CO(g)△H=+172.5kJ•mol-1,则CO(g)+H2O(g)?CO2(g)+H2(g)的△H=-41.2kJ/mol;
(3)在一定温度下,将CO(g)和H2O(g)各0.16mol分别通入到体积为2.0L的恒容密闭容器中,发生以下反应:CO(g)+H2O(g)?CO2(g)+H2(g),得到如下数据:
| t/min | 2 | 4 | 7 | 9 |
| n(H2O)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
②该温度下此反应的平衡常数K=0.36;
③其他条件不变,再充入0.1mol CO和0.1mol H2O(g),平衡时CO的体积分数不变(填“增大”、“减小”、“不变”).
 ,其中氮的化合价为-2.
,其中氮的化合价为-2. .
.