题目内容
20.下列说法正确的是( )| A. | 氮原子的质量就是氮的相对原子质量 | |
| B. | 氢氧化钠的摩尔质量是40 g | |
| C. | 1mol H2SO4中含有1mol H2 | |
| D. | 氩气的摩尔质量在数值上等于它的相对原子质量 |
分析 A.质量与相对分子质量不是同一个物质的量;
B.摩尔质量单位为g/mol;
C.硫酸分子不含有氢分子;
D.摩尔质量以g/mol为单位,在数值上等于相对原子质量.
解答 解:A.质量与相对分子质量不是同一个物质的量,故A错误;
B.氢氧化钠的摩尔质量是40 g/mol,故B错误;
C.硫酸分子含有氢原子,不含有氢分子,故C错误;
D.氩气为单原子分子,摩尔质量在数值上等于它的相对原子质量,故D正确;
故选:D.
点评 本题考查了阿伏伽德罗常数的使用及计算,明确以物质的量为核心的计算公式及物质的结构组成是解题关键,题目难度不大,注意稀有气体为单原子分子.

练习册系列答案
相关题目
10.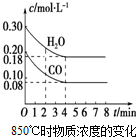 已知:CO(g)+H2O(g)?CO2(g)+H2(g);△H<0
已知:CO(g)+H2O(g)?CO2(g)+H2(g);△H<0
(1)在一体积为10L的密闭容器中,通入一定量的CO和H2O,在850℃时CO和H2O浓度变化如图,则0~4min的平均反应速率v(H2O)=0.03mol•(L•min)-1.
(2)t℃时,在相同容器中发生上述反应,容器内各物质的浓度变化如表:
①若c1数值大于0.08mol•L-1,则温度t>850℃(填“>”“<”或“=”).
②表中3~4min之间反应处于平衡 状态.
③若第5min时,该反应处于化学平衡状态,则此反应的平衡常数K=0.35(保留两位有效数字)
④表中5~6min之间数值发生变化,可能的原因是B.
A.升高温度
B.体积不变,通入水蒸气
C.缩小体积,增大压强
D.体积不变,通入氢气
⑤比较反应物CO在2~3min、5~6min时平均反应速率[平均反应速率分别以v(2~3)、v(5~6)表示]的大小v(2~3)>v(5~6)(假设3~5min内反应条件不变).
⑥能使该反应的反应速率增大,且平衡向正反应方向移动的措施是C.
A.适当升高温度 B.缩小反应容器的体积C.增大CO的浓度 D.选择高效催化剂.
 已知:CO(g)+H2O(g)?CO2(g)+H2(g);△H<0
已知:CO(g)+H2O(g)?CO2(g)+H2(g);△H<0(1)在一体积为10L的密闭容器中,通入一定量的CO和H2O,在850℃时CO和H2O浓度变化如图,则0~4min的平均反应速率v(H2O)=0.03mol•(L•min)-1.
(2)t℃时,在相同容器中发生上述反应,容器内各物质的浓度变化如表:
| 时间/min | c(CO)/mol•L-1 | c(H2O)/mol•L-1 | c(CO2)/mol•L-1 | c(H2)/mol•L-1 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
| 5 | 0.110 | 0.210 | 0.090 | |
| 6 | 0.096 | 0.266 | 0.104 |
②表中3~4min之间反应处于平衡 状态.
③若第5min时,该反应处于化学平衡状态,则此反应的平衡常数K=0.35(保留两位有效数字)
④表中5~6min之间数值发生变化,可能的原因是B.
A.升高温度
B.体积不变,通入水蒸气
C.缩小体积,增大压强
D.体积不变,通入氢气
⑤比较反应物CO在2~3min、5~6min时平均反应速率[平均反应速率分别以v(2~3)、v(5~6)表示]的大小v(2~3)>v(5~6)(假设3~5min内反应条件不变).
⑥能使该反应的反应速率增大,且平衡向正反应方向移动的措施是C.
A.适当升高温度 B.缩小反应容器的体积C.增大CO的浓度 D.选择高效催化剂.
8.有转化关系(其他产物及反应所需条件均已略去).A$\stackrel{X}{→}$B$\stackrel{Cl_{2}}{→}$C$\stackrel{O_{2}}{→}$D$\stackrel{O_{2}}{→}$E$\stackrel{H_{2}O}{→}$F,以下推断错误的是( )
| A. | 当X是盐酸时,则F是稀硝酸24 | |
| B. | 当X是氢氧化钠时,则F是稀硝酸y | |
| C. | 当X是氢氧化钠时,B跟Cl2反应可能有白烟现象e | |
| D. | 当X是氢氧化钠时,B能使酸性高锰酸钾溶液褪色N |
15.若用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 常温常压下,32 g 臭氧中含有2NA个氧原子 | |
| B. | 标准状况下,22.4 L CCl4中含有的分子数为NA | |
| C. | 23 g钠离子中含有的电子数为NA | |
| D. | Zn+2H+=Zn2++H2↑ 2mol H+被氧化时转移2mol 电子 |
12.下列做法正确的是( )
| A. | 为了使火腿肠颜色更鲜红,可多加一些亚硝酸钠 | |
| B. | 为了使婴儿对食品有浓厚兴趣,我们可以在婴儿食品中加少量着色剂 | |
| C. | 食盐加碘是防止人体缺碘而加的营养强化剂,能预防地方性甲状腺肿 | |
| D. | 味精能增加食品的鲜味,促进食欲,炒菜时应该多放一点 |
9.下列说法正确的是( )
| A. | 热化学方程式中,如没有注明温度和压强,表示反应热是在标准状况下测得的数据 | |
| B. | 物质发生化学变化不一定伴随着能量变化 | |
| C. | 发生碰撞的分子只要具有足够的能量,就能够发生有效碰撞 | |
| D. | 化学反应速率可通过实验测定,比如可以测量在一定温度和压强下释放出的气体的体积,或者可以用比色的方法测定溶液颜色的深浅进行换算 |
9.碳及其化合物在工业生产中有广泛的用途.回答下列问题:
(1)C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ•mol-1,以上反应达到平衡后,在体积不变的条件下,以下措施有利于提高H2的产率的是AD;(填序号)
A.升高温度 B.增加碳的用量 C.加入催化剂 D.用CO吸收剂除去CO
(2)又知,C(s)+CO2(g)?2CO(g)△H=+172.5kJ•mol-1,则CO(g)+H2O(g)?CO2(g)+H2(g)的△H=-41.2kJ/mol;
(3)在一定温度下,将CO(g)和H2O(g)各0.16mol分别通入到体积为2.0L的恒容密闭容器中,发生以下反应:CO(g)+H2O(g)?CO2(g)+H2(g),得到如下数据:
①其他条件不变,降低温度,反应达到新平衡前v(逆)<v(正) (填“>”、“<”、“=”)
②该温度下此反应的平衡常数K=0.36;
③其他条件不变,再充入0.1mol CO和0.1mol H2O(g),平衡时CO的体积分数不变(填“增大”、“减小”、“不变”).
(1)C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ•mol-1,以上反应达到平衡后,在体积不变的条件下,以下措施有利于提高H2的产率的是AD;(填序号)
A.升高温度 B.增加碳的用量 C.加入催化剂 D.用CO吸收剂除去CO
(2)又知,C(s)+CO2(g)?2CO(g)△H=+172.5kJ•mol-1,则CO(g)+H2O(g)?CO2(g)+H2(g)的△H=-41.2kJ/mol;
(3)在一定温度下,将CO(g)和H2O(g)各0.16mol分别通入到体积为2.0L的恒容密闭容器中,发生以下反应:CO(g)+H2O(g)?CO2(g)+H2(g),得到如下数据:
| t/min | 2 | 4 | 7 | 9 |
| n(H2O)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
②该温度下此反应的平衡常数K=0.36;
③其他条件不变,再充入0.1mol CO和0.1mol H2O(g),平衡时CO的体积分数不变(填“增大”、“减小”、“不变”).
 ,其中氮的化合价为-2.
,其中氮的化合价为-2. ,该结构的二氯代物有3种.
,该结构的二氯代物有3种.