题目内容
15.小明同学设计了如图所示装置来探究铜跟浓硫酸的反应.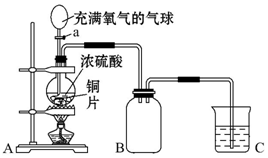
先关闭活塞a,加热至烧瓶中不再有气泡产生时,反应停止,此时烧瓶中铜片仍有剩余.
(1)上述过程A装置中所涉及的化学反应方程式.Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
再打开活塞a,将气球中的氧气缓缓挤入烧瓶,铜片慢慢消失.原因是:(用文字叙述或者化学方程式)铜被氧化成氧化铜,再与稀硫酸反应.
(2)B是收集气体装置.张老师认为B装置设计有误,请你帮助小明改正过来
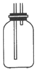
(3)B中所收集到的气体既具有氧化性又具有还原性,请写出一个体现其还原性的化学方程式:2SO2+O2$?_{△}^{催化剂}$2SO3,
(4)装置C中应盛放的试剂为NaOH溶液.作用是吸收尾气.
分析 由图可知,A中发生Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,探究二氧化硫的化学性质,B用于收集二氧化硫,二氧化硫的密度比空气大,进气管应较长,最后C中NaOH溶液吸收尾气,防止污染环境,以此来解答.
解答 解:(1)铜和浓硫酸加热下反应生成硫酸铜、二氧化硫和水,反应为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,再打开活塞a,将气球中的氧气缓缓挤入烧瓶,铜片慢慢消失,发生的反应为:2Cu+2H2SO4+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuSO4+2H2O;或2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO,CuO+H2SO4═CuSO4+2H2O,
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;铜被氧化成氧化铜,再与稀硫酸反应;
(2)B装置是收集装置,二氧化硫气体比空气重,需要用向上排气法收集,导气管长进短出,装置为 ,故答案为:
,故答案为: ;
;
(3)二氧化硫气体的氧化性是硫元素化合价降低,表现还原性是硫元素化合价升高的反应,如:2SO2+O2 $?_{△}^{催化剂}$2SO3,
故答案为:2SO2+O2$?_{△}^{催化剂}$2SO3;
(4)二氧化硫是污染性的气体,不能排放到空气中,需要用氢氧化钠溶液吸收,故答案为:NaOH溶液;吸收尾气.
点评 本题考查二氧化硫的制备及性质实验,为高频考点,把握反应原理及实验装置的作用为解答的关键,侧重分析与实验能力的考查,题目难度不大.

 新编小学单元自测题系列答案
新编小学单元自测题系列答案 字词句段篇系列答案
字词句段篇系列答案| A. | 分子式为C3H6Cl2的有机物有4种同分异构体 | |
| B. | 包装用材料聚乙烯分子中含有碳碳双键 | |
| C. | 乙炔和溴的四氯化碳溶液反应成1,2-二溴乙烷 | |
| D. | 油脂与NaOH浓溶液反应制高级脂肪酸钠属于加成反应 |
| A. | 铁粉放入稀硫酸溶液:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 往NH4HCO3溶液中加过量的NaOH溶液并加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| C. | 石灰石与稀盐酸反应:CO32-+2H+═CO2↑+H2O | |
| D. | Cl2通入水中:Cl2+H2O?H++Cl-+HClO |
| 温度(℃) | 10 | 20 | 30 | 加热煮沸后冷却到50℃ |
| pH | 8.3 | 8.4 | 8.5 | 8.8 |
(1)只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则乙(填“甲”或“乙”)判断正确.试剂X是B
A.Ba(OH)2溶液 B.BaCl2溶液 C.NaOH溶液 D.澄清石灰水
(2)将加热后的溶液冷却到10℃,若溶液的pH等于(填“高于”、“低于”或“等于”)8.3,则甲(填“甲”或“乙”)判断正确.
(3)常温下,在测得pH都等于9的NaOH溶液和Na2CO3溶液中,由水电离的OH-浓度分别为amol/L和bmol/L,则a与b的具体关系是a=10-4b
(4)25℃时,浓度均为0.3mol/L的Na2CO3和NaHCO3溶液中,下列判断不正确的是C
A.均存在电离平衡和水解平衡
B.存在的粒子种类相同
C.c(OH-)前者小于后者
D.分别加入NaOH固体,恢复到原温度,c(CO32-)均增大.
| A. | n/8 | B. | n/16 | C. | 8n | D. | 16n |
(1)第一份加入足量的烧碱并加热,产生的气体在标准状况下为224mL;
(2)第二份先加入足量的盐酸,无现象,再加入足量的BaCl2溶液,得固体2.33g.
(3)在(2)的滤液中滴入AgNO3,产生白色沉淀,加稀硝酸,沉淀不溶解.
下列说法正确的是( )
| A. | 该溶液中可能含Na+ | B. | 该溶液中肯定含有NH4+、SO42-、Cl- | ||
| C. | 该溶液中一定不含NO3-、CO3- | D. | 该溶液中一定含有Na+ |
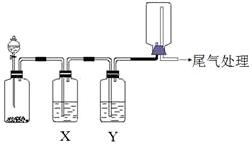 利用图装置可以进行实验并能达到实验目的是( )
利用图装置可以进行实验并能达到实验目的是( )| 选项 | 实验目的 | X中试剂 | Y中试剂 |
| A | 用MnO2和浓盐酸制取并收集纯净干燥的Cl2 | 饱和食盐水 | 浓硫酸 |
| B | 用Cu与稀硝酸制取并收集纯净干燥的NO | 水 | 浓硫酸 |
| C | 用CaO于浓氨水制取并收集纯净干燥的NH3 | NaOH溶液 | 碱石灰 |
| D | CaCO3和稀盐酸制取并收集纯净干燥的CO2 | 饱和NaHCO3溶液 | 浓硫酸 |
| A. | A | B. | B | C. | C | D. | D |
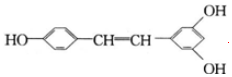 )广泛存在于食物(例如桑葚、花生、尤其是葡萄)中,它可能具有抗癌性,能够跟1mol该化合物起反应的Br2和H2的最大用量分别是6mol、7mol.
)广泛存在于食物(例如桑葚、花生、尤其是葡萄)中,它可能具有抗癌性,能够跟1mol该化合物起反应的Br2和H2的最大用量分别是6mol、7mol.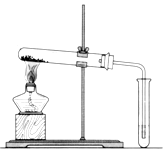 碳酸钠(Na2CO3)和碳酸氢钠(NaHCO3)都可作为食用碱.
碳酸钠(Na2CO3)和碳酸氢钠(NaHCO3)都可作为食用碱.