题目内容
20.有分别含有A、B、C、D、E、F的六瓶无色溶液(中学常用的无机试剂).已知纯E为无色油状液体,溶于水时会放出大量热;B、C、D和F是常见金属的盐,且它们的阴离子均不同.现进行如下实验:①A的溶质为有刺激性气味的气体,其水溶液用沾有浓盐酸的玻璃棒接近时产生白色烟雾;
②将A的溶液分别加入其它五种物质的溶液中,只有溶有D、F的溶液中有白色沉淀产生;继续加入过量A溶液时,D中沉淀无变化,F中沉淀完全溶解;
③将B的溶液分别加入C、D、E、F的溶液中,含C、D、F的三种溶液中均产生沉淀,D、E溶液中有无色、无味气体逸出;
④将C的溶液分别加入D、E、F中,均有白色沉淀生成,再加入稀HNO3,沉淀均不溶.其中一种沉淀在医疗上有非常重要的用途,其密度很大,且能够阻止X射线通过.
根据上述实验信息,请回答下列问题:
(1)溶质C对水的电离平衡是无影响(填“促进”、“抑制”或“无影响”,下同),溶质D对水的电离平衡是促进(填“促进”、“抑制”或“无影响”).
(2)确定溶液B中的阳离子通过焰色反应(填方法)鉴定.
(3)写出上述六种溶液能采用两溶液互滴法就可鉴别的所有溶液组NH3•H2O和AgNO3;H2SO4和K2CO3.
(4)将等体积、等物质的量浓度的A溶液和E溶液混合,反应后溶液中各种离子浓度由大到小的顺序为c(H+)>c(SO42-)>c(NH4+)>c(OH-).
(5)已知常温下BaSO4的溶解度为2.33×10-4g,则Ksp(X)=1.0×10-10.
分析 含有A、B、C、D、E、F的六瓶无色溶液,B、C、D和F是常见金属的盐,且它们的阴离子均不同,
①A有刺激性气味,用沾有浓盐酸的玻璃棒接近A时产生白色烟雾,说明A为NH3•H2O;
②将A分别加入其它五种溶液中,只有D、F中有沉淀产生;继续加入过量A时,D中沉淀无变化,可能为Al(OH)3或Mg(OH)2,F中沉淀完全溶解,则F为AgNO3,D可能为Al2(SO4)3或MgSO4;
③将B分别加入C、D、E、F中,C、D、F中产生沉淀,D、E中有无色、无味气体逸出,该气体为CO2,说明E为酸溶液,且纯E为无色油状液体,说明E为H2SO4;
④将C分别加入D、E、F中,均有沉淀生成,再加入稀HNO3,沉淀均不溶,则该沉淀可能为BaSO4或AgCl,则C应为BaCl2,B可能为Na2CO3或K2CO3,其中一种沉淀在医疗上有非常重要的用途,其密度很大,且能够阻止X射线通过,说明生成硫酸钡沉淀,综上所述,A为NH3•H2O、B为Na2CO3或K2CO3、C为BaCl2、D为Al2(SO4)3或MgSO4、E为H2SO4、F为AgNO3,以此解答该题.
解答 解:①A有刺激性气味,用沾有浓盐酸的玻璃棒接近A时产生白色烟雾,说明A为NH3•H2O;
②将A分别加入其它五种溶液中,只有D、F中有沉淀产生;继续加入过量A时,D中沉淀无变化,可能为Al(OH)3或Mg(OH)2,F中沉淀完全溶解,则F为AgNO3,D可能为Al2(SO4)3或MgSO4;
③将B分别加入C、D、E、F中,C、D、F中产生沉淀,D、E中有无色、无味气体逸出,该气体为CO2,说明E为酸溶液,且纯E为无色油状液体,说明E为H2SO4;
④将C分别加入D、E、F中,均有沉淀生成,再加入稀HNO3,沉淀均不溶,则该沉淀可能为BaSO4或AgCl,则C应为BaCl2,B可能为Na2CO3或K2CO3,其中一种沉淀在医疗上有非常重要的用途,其密度很大,且能够阻止X射线通过,说明生成硫酸钡沉淀,综上所述,A为NH3•H2O、B为Na2CO3或K2CO3、C为BaCl2、D为Al2(SO4)3或MgSO4、E为H2SO4、F为AgNO3,
(1)C为BaCl2,是强酸强碱盐,所以对水的电离平衡无影响,D为Al2(SO4)3或MgSO4、镁离子或铝离子能水解,对水的电离平衡起促进作用,
故答案为:无影响;促进;
(2)B为Na2CO3或K2CO3,确定溶液B中的阳离子即钾离子或钠离子,可以通过焰色反应鉴定,
故答案为:焰色反应;
(3)在NH3•H2O和AgNO3 中,将氨水滴入硝酸银溶液中,先出现白色沉淀后沉淀溶解,如果将硝酸银溶液滴入氨水溶液中先无明显现象,硝酸银过量则有白色沉淀,据此可以鉴别NH3•H2O和AgNO3,将H2SO4滴入K2CO3溶液中,先无明显现象后有气体出现,如果将K2CO3溶液滴入H2SO4溶液中一开始就有气体产生,据此可以鉴别H2SO4和K2CO3,
故答案为:NH3•H2O和AgNO3;H2SO4和K2CO3;
(4)A为NH3•H2O、E为H2SO4,将等体积、等物质的量浓度的A溶液和E溶液混合,生成NH4HSO4,铵根离子水解,所以反应后溶液中各种离子浓度由大到小的顺序为c(H+)>c(SO42-)>c(NH4+)>c(OH-),
故答案为:c(H+)>c(SO42-)>c(NH4+)>c(OH-);
(5)已知常温下BaSO4的溶解度为2.33×10-4g,则BaSO4的物质的量的浓度为$\frac{\frac{2.33×10{\;}^{-4}g}{233g/mol}}{0.1L}$=1.0×10-5mol/L,则c(Ba2+)=c(SO42-)=1.0×10-5mol/L,所以Ksp(X)=c(Ba2+)•c(SO42-)=1.0×10-10,
故答案为:1.0×10-10.
点评 本题考查无机物的推断,为高考常见题型,题目难度中等,涉及了物质检验、离子方程式书写等知识,注意掌握常见物质的检验方法,能够根据反应现象判断未知物成分,试题培养了学生的分析、理解能力.

 导学全程练创优训练系列答案
导学全程练创优训练系列答案| A. | 使用高效催化剂 | B. | 充入更多N2 | C. | 降低温度 | D. | 增大压强 |
| A. | C(HCO3-)=0.1mol/L的溶液中:NH4+、Al3+、Cl-、NO3- | |
| B. | 室温下,PH=2的溶液中:Fe2+、SO42-、Na+、NO3- | |
| C. | 无色透明的溶液中:NH4+、Cl-、NO3-、Fe3+ | |
| D. | 使红色石蕊试纸变蓝的溶液中:SO32-、Na+、CO32-、K+ |
已知Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH见表:
| Fe3+ | Fe2+ | Cu2+ | |
| 氢氧化物开始沉淀时的pH | 1.9 | 7 | 4.7 |
| 氢氧化物沉淀完全时的pH | 3.2 | 9 | 6.7 |
(2)有人用强氧化剂NaClO先将Fe2+氧化为Fe3+,再调整溶液的PH将Fe3+沉淀除去:你认为用NaClO作氧化剂是否妥当?否(填“是”或“否”),现有下列几种常用的氧化剂,可用于除去混合溶液中Fe2+的有BD(有几个选几个,填代号,下同).
A.浓HNO3 B.Cl2 C.KMnO4 D.H2O2
(3)①加入适当物质调整溶液pH,使Fe3+转化为Fe(OH)3沉淀,可以达到除去Fe3+而不损失CuCl2的目的,则调整溶液pH可选用下列物质中的AD.
A.CuO B.NH3•H2O C.NaOH D.Cu(OH)2
②加上述物质调节溶液的PH为3.2~4.7,原因是铁离子沉淀完全时的PH值为3.2,铜离子开始沉淀时的PH值为4.7,除杂时要使铁离子沉淀完全,不能使铜离子产生沉淀
(4)最后能不能直接将溶液蒸发得到CuCl2•2H2O?不能(填“能”或者“不能”).若不能,应该如何操作才能得到CuCl2•2H2O应在氯化氢气氛中浓缩后冷却结晶(若填“能”,此空不用回答)
Ⅰ.分别向盛有0.5g Na2CO3固体、0.5g NaHCO3固体的烧杯中加入10mL水(20℃),搅拌,测量温度为T1;
Ⅱ.静置恒温后测量温度为T2;
Ⅲ.分别加入10mL 密度约为1.1g/mL 20%的盐酸(20℃),搅拌,测量温度T3.
得到表1的数据:
表1
 | T1/℃ | T2/℃ | T3/℃ |
| Na2CO3 | 23.3 | 20.0 | 23.7 |
| NaHCO3 | 18.5 | 20.0 | 20.8 |
(1)Na2CO3溶于水显碱性,其原因是CO32-+H2O?HCO3-+OH-、HCO3-+H2O?H2CO3+OH-(用离子方程式表示).
(2)根据试题后的附表判断:
步骤Ⅰ中Na2CO3、NaHCO3固体分别是全部溶解还是部分溶解Na2CO3、NaHCO3固体都是全部溶解.
(3)分析表1的数据得出:Na2CO3固体溶于水放热,NaHCO3固体溶于水吸热
(填“放热”或“吸热”).
(4)甲同学分析上述数据得出:Na2CO3和NaHCO3与盐酸反应都是放热反应.
乙同学认为应该增加一个实验,并补做如下实验:向 盛 有10 mL水(20℃)的烧杯中加入10mL密度约为1.1g/mL20%的盐酸,搅拌,测量温度为22.2℃.
(5)结合上述探究,下列说法正确的是AC.
A.NaHCO3与盐酸的反应是吸热反应
B.不能用稀盐酸鉴别Na2CO3和NaHCO3固体
C.Na2CO3、NaHCO3固体与稀盐酸反应的能量变化还与物质的溶解等因素有关
(6)丙同学为测定一份NaHCO3和Na2CO3混合固体中NaHCO3的纯度,称取m1 g混合物,加热至质量不变时,称其质量为m2 g,则原混合物中NaHCO3的质量分数为$\frac{84(m{\;}_{1}-m{\;}_{2})}{31m{\;}_{1}}$×100%(用代数式表示).
附表:溶解度表
 | 10℃ | 20℃ | 30℃ | 40℃ |
| Na2CO3 | 12.5g | 21.5g | 39.7g | 40.0g |
| NaHCO3 | 8.1g | 9.6g | 11.1g | 12.7g |
①将NaOH溶液分多次加入到AlCl3溶液中(边加边搅拌);
②将AlCl3溶液分多次加入到NaOH溶液中(边加边搅拌).
比较两次实验的结果,其中正确的是( )
| A. | 现象相同,沉淀量相等 | B. | 现象不同,沉淀量不等 | ||
| C. | 现象相同,沉淀量不等 | D. | 现象不同,沉淀量相等 |
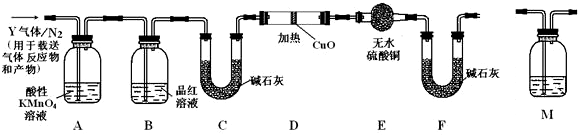
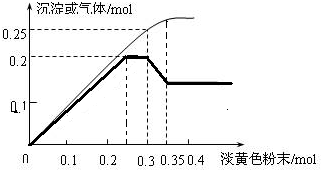 图象分析是化学研究的一种重要的手段.某同学分析某无色透明溶液,已知其中可能含有Fe3+、Mg2+、Cu2+、Al3+、NH4+,加入淡黄色粉末(过氧化钠)并加热,产生沉淀或气体的物质的量与淡黄色粉末的物质的量关系如图所示(假设产生的气体全部逸出).请回答:
图象分析是化学研究的一种重要的手段.某同学分析某无色透明溶液,已知其中可能含有Fe3+、Mg2+、Cu2+、Al3+、NH4+,加入淡黄色粉末(过氧化钠)并加热,产生沉淀或气体的物质的量与淡黄色粉末的物质的量关系如图所示(假设产生的气体全部逸出).请回答: