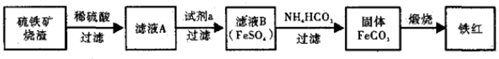
题目内容
8.雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中共生.根据题意完成下列填空:(1)As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体.若As2S3和SnCl2正好完全反应,As2S3和SnCl2的物质的量之比为1:1.
(2)上述反应中的氧化剂是As2S3,反应产生的气体可用NaOH溶液吸收.
(3)As2S3和HNO3有如下反应:As2S3+10H++10NO3-=2H3AsO4+3S+10NO2↑+2H2O
若生成2mol H3AsO4,则反应中转移电子的物质的量为10mol.若将该反应设计成一原电池,则NO2应该在正极(填“正极”或“负极”)附近逸出.
(4)若反应产物NO2与11.2L O2(标准状况)混合后用水吸收全部转化成浓HNO3,然后与过量的碳反应,所产生的CO2的量 a(选填编号).
a.小于0.5mol b.等于0.5mol c.大于0.5mol d.无法确定.
分析 (1)As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体,反应的方程式为2As2S3+2SnCl2+4HCl=As4S4+2SnCl4+2H2S↑,可根据方程式或化合价的变化判断;
(2)根据反应物中某元素化合价的升高来分析还原剂,并利用气体的性质来分析气体的吸收,离子反应方程式为:H2S+2OH-=2H2O+S2-、S2-+H2S=2HS-;
(3)As2S3和浓HNO3反应生成H3AsO4、S和NO2,所以反应的化学方程式为:As2S3+10HNO3═2H3AsO4+3S↓+10NO2↑+2H2O,根据化合价升降用单线桥法表示电子转移的方向和数目;
(4)后阶段生成NO、NO2、N2O4,生成的气体恰好与11.2L O2(标准状况)混合后用水吸收全部转化成浓HNO3,然后与过量的碳在加热时反应仍生成二氧化氮,相当于一氧化氮和碳失电子给0.5mol的氧气得电子,利用得失电子守恒来分析解答.
解答 解:(1)根据电子得失守恒知1molAs2S3作氧化剂得到2mol电子,而1molSnCl2作还原剂失去2mol电子,所以二者的物质的量之比是1:1,故答案为:1:1;
(2)反应中SnCl2中的Sn元素化合价升高,SnCl2为还原剂,As2S3作氧化剂,H2S为酸性气体,可用NaOH溶液吸收,离子反应方程式为:H2S+2OH-=2H2O+S2-、S2-+H2S=2HS-,故答案为:As2S3;NaOH溶液;
(3)As2S3和浓HNO3反应生成H3AsO4、S和NO2,所以反应的化学方程式为:As2S3+10HNO3═2H3AsO4+3S↓+10NO2↑+2H2O,用单线桥法表示电子转移的方向和数目为: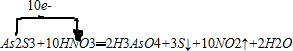 ,若生成2mol H3AsO4,则反应中转移电子的物质的量为10mol,若将该反应设计成一原电池,在原电池的正极上硝酸根发生得电子的还原反应,产生二氧化氮,则NO2应该在正极附近逸出,故答案为:10mol;正极;
,若生成2mol H3AsO4,则反应中转移电子的物质的量为10mol,若将该反应设计成一原电池,在原电池的正极上硝酸根发生得电子的还原反应,产生二氧化氮,则NO2应该在正极附近逸出,故答案为:10mol;正极;
(4)后阶段生成NO、NO2、N2O4,生成的气体恰好与11.2L O2(标准状况)混合后用水吸收全部转化成浓HNO3,然后与过量的碳在加热时反应仍生成二氧化氮,相当于一氧化氮和碳失电子给0.5mol的氧气得电子,利用得失电子守恒,4n(O2)=4n(C)+2n(NO),因为:2n(NO)>0,所以4n(O2)>4n(C),即n(C)<n(O2)=0.5,则产生的CO2的量小于0.5mol,
故选a.
点评 本题考查氧化还原反应、混合物计算等知识,难度中等,侧重考查学生的分析思维能力与解题方法技巧,注意利用守恒法进行解答.

 考前必练系列答案
考前必练系列答案| A. | 2.7g金属铝变成铝离子时失去的电子数目为0.1NA (提示:M(Al)=27g/mol) | |
| B. | 17g氨气所含的电子数目为10NA (提示:M(NH3)=17g/mol) | |
| C. | 2g氢气所含原子数目为NA (提示:M(H2)=2g/mol) | |
| D. | 常温常压下,11.2L氮气所含的原子数目为NA |
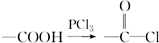
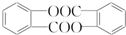 .
.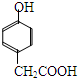 .
.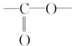 结构
结构