题目内容
9.某小组探究Na2CO3和NaHCO3的性质,实验步骤及记录如下:Ⅰ.分别向盛有0.5g Na2CO3固体、0.5g NaHCO3固体的烧杯中加入10mL水(20℃),搅拌,测量温度为T1;
Ⅱ.静置恒温后测量温度为T2;
Ⅲ.分别加入10mL 密度约为1.1g/mL 20%的盐酸(20℃),搅拌,测量温度T3.
得到表1的数据:
表1
 | T1/℃ | T2/℃ | T3/℃ |
| Na2CO3 | 23.3 | 20.0 | 23.7 |
| NaHCO3 | 18.5 | 20.0 | 20.8 |
(1)Na2CO3溶于水显碱性,其原因是CO32-+H2O?HCO3-+OH-、HCO3-+H2O?H2CO3+OH-(用离子方程式表示).
(2)根据试题后的附表判断:
步骤Ⅰ中Na2CO3、NaHCO3固体分别是全部溶解还是部分溶解Na2CO3、NaHCO3固体都是全部溶解.
(3)分析表1的数据得出:Na2CO3固体溶于水放热,NaHCO3固体溶于水吸热
(填“放热”或“吸热”).
(4)甲同学分析上述数据得出:Na2CO3和NaHCO3与盐酸反应都是放热反应.
乙同学认为应该增加一个实验,并补做如下实验:向 盛 有10 mL水(20℃)的烧杯中加入10mL密度约为1.1g/mL20%的盐酸,搅拌,测量温度为22.2℃.
(5)结合上述探究,下列说法正确的是AC.
A.NaHCO3与盐酸的反应是吸热反应
B.不能用稀盐酸鉴别Na2CO3和NaHCO3固体
C.Na2CO3、NaHCO3固体与稀盐酸反应的能量变化还与物质的溶解等因素有关
(6)丙同学为测定一份NaHCO3和Na2CO3混合固体中NaHCO3的纯度,称取m1 g混合物,加热至质量不变时,称其质量为m2 g,则原混合物中NaHCO3的质量分数为$\frac{84(m{\;}_{1}-m{\;}_{2})}{31m{\;}_{1}}$×100%(用代数式表示).
附表:溶解度表
 | 10℃ | 20℃ | 30℃ | 40℃ |
| Na2CO3 | 12.5g | 21.5g | 39.7g | 40.0g |
| NaHCO3 | 8.1g | 9.6g | 11.1g | 12.7g |
分析 (1)碳酸钠为强碱弱酸盐,碳酸根离子水解导致溶液呈碱性;
(2)根据溶解度分别求出10mL水(20℃)分别溶解的Na2CO3、NaHCO3固体与0.5g作比较分析;
(3)分析表1的数据得出:T1/℃,Na2CO3固体溶于水温度升高,NaHCO3固体溶于水温度降低;
(4)需探究盐酸溶于水温度的变化;
(5)A.分析表1的数据得出NaHCO3与盐酸的反应是吸热反应;
B.Na2CO3和NaHCO3固体二者与酸反应的快慢不同;
C.从温度变化可判别Na2CO3、NaHCO3固体与稀盐酸反应的能量变化还与物质的溶解等因素有关.
(6)根据质量守恒定律,由加热前后剩余物质的质量差可求得分解反应出二氧化碳与水的质量即固体减少的质量,由固体减少的质量根据化学方程式计算出样品中碳酸氢钠质量,并进一步计算样品中碳酸氢钠的质量分数.
解答 解:(1)碳酸钠为强碱弱酸盐,钠离子不水解、碳酸根离子水解导致溶液呈碱性,水解离子方程式为CO32-+H2O?HCO3-+OH-,HCO3-+H2O?H2CO3+OH-,
故答案为:CO32-+H2O?HCO3-+OH-、HCO3-+H2O?H2CO3+OH-;
(2)10mL水(20℃)溶解Na2CO3固体质量为:m=$\frac{10mL}{100mL}$×21.5g=2.15g>0.5g,10mL水(20℃)溶解NaHCO3固体质量为:m=$\frac{10mL}{100mL}$×9.6g=0.96g>0.5g,0.5gNa2CO3、NaHCO3固体都是全部溶解,
故答案为:Na2CO3、NaHCO3固体都是全部溶解;
(3)分析表1的数据得出:T1/℃,Na2CO3固体溶于水温度从20℃升高到23.3℃,放热,NaHCO3固体溶于水温度从20℃升高到18.5℃,吸热,
故答案为:放热;吸热;
(4)强酸溶于水放热,盐酸为强酸,所以需增加探究盐酸溶于水温度的变化,即10mL密度约为1.1g/mL20%的盐酸搅拌,测量温度为22.2℃,
故答案为:密度约为1.1g/mL20%的盐酸;
(5)A.盐酸溶于水放热,测量温度为22.2℃,T1/℃,NaHCO3固体溶于水温度从20℃升高到18.5℃,吸热,两者反应恒温后测量温度T3为20.8℃低于22.2℃,所以NaHCO3与盐酸的反应是吸热反应,故A正确;
B.用稀盐酸鉴别NaHCO3和Na2CO3溶液,反应较快的为NaHCO3,能鉴别,故B错误;
C.从上述温度变化数值可判别Na2CO3、NaHCO3固体与稀盐酸反应的能量变化还与物质的溶解等因素有关,故C正确.
故选AC;
(6)设样品中碳酸氢钠的质量为x.
2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O↑+CO2↑ 固体质量减少
168 106 168-106=62
x m1-m2
$\frac{168}{62}$=$\frac{x}{m{\;}_{1}-m{\;}_{2}}$ x=$\frac{84(m{\;}_{1}-m{\;}_{2})}{31}$样品中碳酸氢钠的质量分数=$\frac{84(m{\;}_{1}-m{\;}_{2})}{31m{\;}_{1}}$×100%
故答案为:$\frac{84(m{\;}_{1}-m{\;}_{2})}{31m{\;}_{1}}$×100%.
点评 本题以Na2CO3和NaHCO3为载体考查物质的性质实验,为高考常见题型,侧重于学生的分析能力和实验能力的考查,抓住题干信息以及Na2CO3和NaHCO3的性质是解答本题的关键,注意物质性质的差异,题目难度中等.

| A. | 26.3 | B. | 13.2 | C. | 19.8 | D. | 无法计算 |
| A. | 2.7g金属铝变成铝离子时失去的电子数目为0.1NA (提示:M(Al)=27g/mol) | |
| B. | 17g氨气所含的电子数目为10NA (提示:M(NH3)=17g/mol) | |
| C. | 2g氢气所含原子数目为NA (提示:M(H2)=2g/mol) | |
| D. | 常温常压下,11.2L氮气所含的原子数目为NA |
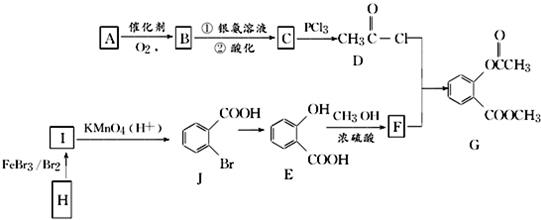
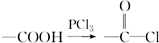
 .
.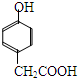 .
.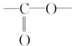 结构
结构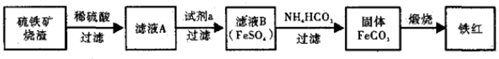
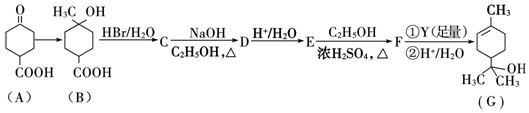
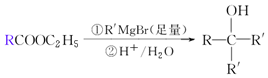
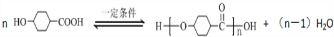 .
. .①核磁共振氢谱有2个吸收峰 ②能发生银镜反应
.①核磁共振氢谱有2个吸收峰 ②能发生银镜反应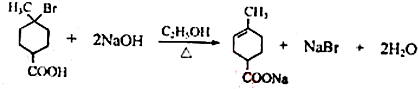 .
.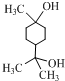 .
.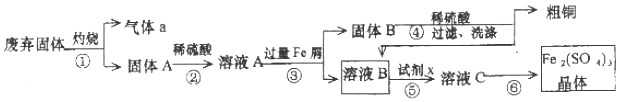

 (2)加30%的H2O2溶液的目的是氧化Fe2+为Fe3+,有利于在沉铁过程中除去.
(2)加30%的H2O2溶液的目的是氧化Fe2+为Fe3+,有利于在沉铁过程中除去.