题目内容
9. 草酸亚铁晶体(FeC2O4•2H2O)呈淡黄色.某课题组为探究草酸业铁晶体的化学性质,进行了一系列实验探究.
草酸亚铁晶体(FeC2O4•2H2O)呈淡黄色.某课题组为探究草酸业铁晶体的化学性质,进行了一系列实验探究.(1)向盛有草酸亚铁晶体的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现溶液颜色逐渐变为棕黄色,并检测到二氧化碳气体生成.这说明草酸亚铁晶体具有还原性(填“氧化性”、“还原性”或“碱性”).若反应中消耗1mol FeC2O4•2H2O,则参加反应的KMnO4为0.6mol.
(2)资料表明:在密闭容器中加热到一定温度时,草酸亚铁晶体可完全分解,生成几种氧化物,残留物为黑色固体.课题组根据课本上所介绍的铁的氧化物的性质,对黑色固体的组成提出如下假设,请你完成假设二和假设三:
假设一:全部是FeO
假设二:全部是Fe3O4
假设三:是FeO和Fe3O4的混合物
(3)为验证上述假设一是否成立,课题组进行如下研究.
【定性研究】请你完成下表中内容.
| 实验步骤(不要求写出具体操作过程) | 预期实验现象和结论 |
| 取少量黑色固体,加入适量稀盐酸(或稀硫酸)溶解,在溶液中加入KSCN溶液 | 若溶液不变红色,则假设一成立;若溶液变红色,则假设一不成立 |
分析 (1)高锰酸钾溶液的紫红色褪去,溶液变为棕黄色,是FeC2O4被高锰酸钾氧化为Fe3+的结果,有二氧化碳气体生成,碳元素也被氧化,表明FeC2O4具有还原性;
反应中Fe元素化合价由+2价升高为+3价,而C元素化合价由+3价是为+4价,Mn元素化合价由+7价降低为+2价,根据得失电子数相等计算参加反应的KMnO4的物质的量;
(2)铁的氧化物中,呈黑色的有FeO和Fe3O4;
(3)定性研究:FeO与盐酸或硫酸反应生成Fe2+,Fe2+与KSCN不反应,但Fe3O4或FeO和Fe3O4的混合物溶于稀盐酸或稀硫酸中生成Fe3+,遇KSCN变红色;
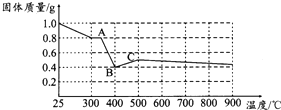
定量研究:草酸亚铁品体受热首先失去结晶水,晶体中结晶水的质量为1.0g×$\frac{36}{180}$=0.2g,全部失去结晶水后固体质量为1g-0.2g=0.8g,则A点对应的物质为FeC2O4,400℃时固体质量减少,应该是FeC2O4发生分解,生成铁的氧化物(即B点对应物质).根据图象可知1.0g晶体分解生成的铁的氧化物的质量为0.4g,设此铁的氧化物的化学式为FeaOb,根据Fe守恒可知0.4g此氧化物中铁元素的质量为1.0g×$\frac{56}{180}$,氧元素的质量为(0.4g-1.0g×$\frac{56}{180}$)g,故a:b=(1.0g×$\frac{56}{180}$):(0.4g-1.0g×$\frac{56}{180}$),解得a:b=1:1,即晶体分解所得铁的氧化物为FeO;
此后,残留固体的质量逐渐增大,显然是被空气中的氧气所氧化,生成了铁的其他氧化物,固体质量肯定会大于4.0g.
解答 解:(1)高锰酸钾溶液的紫红色褪去,溶液变为棕黄色,是FeC2O4被高锰酸钾氧化为Fe3+的结果,有二氧化碳气体生成,碳元素也被氧化,表明FeC2O4具有还原性;
反应中Fe元素化合价由+2价升高为+3价,而C元素化合价由+3价是为+4价,Mn元素化合价由+7价降低为+2价,若反应中消耗1mol FeC2O4•2H2O,根据得失电子数相等,参加反应的KMnO4的物质的量为$\frac{1mol×1+1mol×2}{7-2}$=0.6mol,
故答案为:还原性;0.6;
(2)铁的氧化物中,呈黑色的有FeO和Fe3O4,则:
假设二:全部是Fe3O4,
假设三:是FeO和Fe3O4的混合物,
故答案为:全部是Fe3O4;是FeO和Fe3O4的混合物;
(3)定性研究:取少量黑色固体,加入适量稀盐酸(或稀硫酸)溶解,在溶液中加入KSCN溶液,若溶液不变红色,则假设一成立;若溶液变红色,则假设一不成立,
定量研究:草酸亚铁品体受热首先失去结晶水,晶体中结晶水的质量为1.0g×$\frac{36}{180}$=0.2g,全部失去结晶水后固体质量为1g-0.2g=0.8g,则A点对应的物质为FeC2O4,400℃时固体质量减少,应该是FeC2O4发生分解,生成铁的氧化物(即B点对应物质).根据图象可知1.0g晶体分解生成的铁的氧化物的质量为0.4g,设此铁的氧化物的化学式为FeaOb,根据Fe守恒可知0.4g此氧化物中铁元素的质量为1.0g×$\frac{56}{180}$,氧元素的质量为(0.4g-1.0g×$\frac{56}{180}$)g,故a:b=(1.0g×$\frac{56}{180}$):(0.4g-1.0g×$\frac{56}{180}$),解得a:b=1:1,即晶体分解所得铁的氧化物为FeO,℃时,FeC2O4•2H2O晶体受热分解的化学方程式为:FeC2O4•2H2O$\frac{\underline{\;\;△\;\;}}{\;}$FeO+CO↑+CO2↑+2H2O,
由于坩埚是敞口容器,实验未在密闭容器中进行,FeO会被空气中的氧气进一步氧化,生成铁的其他氧化物,固体质量肯定会大于4.0g,该同学的说法不正确,
故答案为:
| 实验步骤(不要求写出具体操作过程) | 预期实验现象和结论 |
| 取少量黑色固体,加入适量稀盐酸(或稀硫酸)溶解,在溶液中加入KSCN溶液 | 若溶液不变红色,则假设一成立;若溶液变红色,则假设一不成立 |
点评 本题以探究实验为基础,考查了氧化还原反应、探究基本方法、物质的检验、化学计算等相关知识,是对学生综合能力的考查,难度中等.

| A. | Na202与足量H20反应生成标况下11.2L 02.转移电子的数目为2NA | |
| B. | 标准状况下,2.24L S03中所含电子数为4NA | |
| C. | 用惰性电极电解CuS04溶液后,如果加入0.1mol Cu(0H)2能使溶液复原,则电路中转移电子的数目为0.2NA | |
| D. | 0℃和101kp的条件下,1.12L甲烷完全燃烧生成的水分子数为0.1NA |
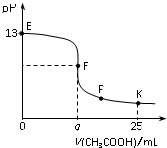 25℃时,在25 mL 0.1 mol/L的NaOH溶液中逐滴加入0.2mol/L CH3COOH溶液,混合溶液pH的变化曲线如图所示,下列分析结论正确的是( )
25℃时,在25 mL 0.1 mol/L的NaOH溶液中逐滴加入0.2mol/L CH3COOH溶液,混合溶液pH的变化曲线如图所示,下列分析结论正确的是( )| A. | a=12.5,且混合溶液pH=7 | |
| B. | 对应曲线上E、F之间的任何一点,溶液中都有c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| C. | P点时,c(CH3COO-)>c(Na+)>c(H+)=c(OH-) | |
| D. | K点时,c(CH3COO-)+c(CH3COOH)=2c(Na+) |
| A. | Fe2O3+3CO═2Fe+3CO2 | B. | Ca(OH)2+CO2═CaCO3↓+H2O | ||
| C. | CuO+H2═Cu+H2O | D. | 2Na+Cl2═2NaCl |

 ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题: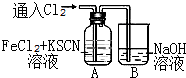 甲学生对Cl2与FeCl2和KSCN混合溶液的反应进行实验探究.向A中通入氯气至过量,发现A中溶液先呈红色后逐渐变为黄色.
甲学生对Cl2与FeCl2和KSCN混合溶液的反应进行实验探究.向A中通入氯气至过量,发现A中溶液先呈红色后逐渐变为黄色.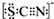 .则碳元素的化合价是+4
.则碳元素的化合价是+4